题目内容
10.下列反应既属于氧化还原反应又符合图示能量变化的是( )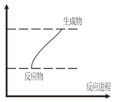
| A. | 灼热的炭与CO2的反应 | B. | 铝片与稀盐酸的反应 | ||
| C. | Ba(OH)2•8H2O和NH4Cl的反应 | D. | 甲烷在氧气中的燃烧反应 |
分析 由图可知反应物总能量小于生成物总能量,则应为吸热反应,如发生氧化还原反应,应存在元素化合价的变化,以此解答该题.
解答 解:A.灼热的木炭与CO2反应为吸热反应,C元素的化合价变化,为氧化还原反应,故A正确;
B.金属与盐酸的反应放热,Al、H元素的化合价变化,为氧化还原反应,故B错误;
C.Ba(OH)2•8H2O晶体与NH4Cl晶体的反应为吸热反应,但没有元素的化合价变化,为非氧化还原反应,故C错误;
D.甲烷在氧气中的燃烧反应为放热反应,故D错误.
故选A.
点评 本题考查氧化还原反应及反应中能量变化,为高频考点,把握反应中元素的化合价变化及能量变化为解答的关键,题目难度不大.

练习册系列答案
相关题目
1.选择环保的装修材料可以有效地减少居室污染.劣质胶合板释放出的主要污染物是( )
| A. | NO | B. | CO | C. | 甲醛 | D. | SO2 |
5.以下物质间的每步转化,存在不能通过一步反应实现的是( )
| A. | S→SO2→SO3→H2SO4 | B. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 | ||
| C. | Al→Al2O3→Al(OH)3→NaAlO2 | D. | N2→NO→NO2→HNO3 |
15.下列说法中错误的是( )
| A. | 电子云表示电子在核外单位体积的空间出现的机会多少 | |
| B. | 同一原子处于激发态时的能量一定高于基态时的能量 | |
| C. | 各能级包含的原子轨道数按s、p、d、f的顺序依次为1、3、5、7 | |
| D. | 1个原子轨道里最多只能容纳2个电子,且自旋方向相同 |
2.下列各组离子,在强碱性溶液中可以大量共存的是( )
| A. | Na+、Ba2+、NO3-、Cl- | B. | K+、Na+、H+、Cl- | ||
| C. | K+、NH4+、S2-、CO32- | D. | Cu2+、Na+、Cl-、SO42- |
15.二甲醚(CH3OCH3)在未来可能替代柴油和液化石油气作为洁净燃料使用.工业上以CO和H2为原料生产CH3OCH3.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230℃~280℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5k1•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)催化反应室中总反应的热化学方程式为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-246.1kJ•mol-1.
830℃时反应③的K=1.0,则在催化反应室中反应③的K>1.0(填“>”、“<”或“=”).
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L、c(H2)=2.4mol/L,5min后达到平衡、CO的转化率为50%,则5min内CO的平均反应速率为0.1mol/(L•min).
(3)反应②2CH3OH(g)═CH3OCH3(g)+H2O(g) 在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:υ(正)>υ(逆) (填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol•L-1.
(4)“二甲醚燃料电池”是一种绿色电源,其中工作原理如图所示.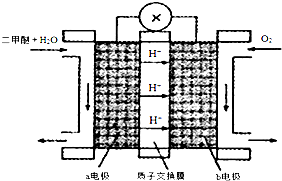
①该电池a电极上发生的电极反应式CH3OCH3+3H2O-12e-=2CO2+12H+.
②如果用该电池作为电解装置,当有23g二甲醚发生反应时,则理论上提供的电量表达式为0.5mol×12×1.6×10-19C×6.02×1023
mol-1C (1个电子的电量为1.6×10-19C).
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5k1•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)催化反应室中总反应的热化学方程式为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-246.1kJ•mol-1.
830℃时反应③的K=1.0,则在催化反应室中反应③的K>1.0(填“>”、“<”或“=”).
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L、c(H2)=2.4mol/L,5min后达到平衡、CO的转化率为50%,则5min内CO的平均反应速率为0.1mol/(L•min).
(3)反应②2CH3OH(g)═CH3OCH3(g)+H2O(g) 在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.64 | 0.50 | 0.50 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol•L-1.
(4)“二甲醚燃料电池”是一种绿色电源,其中工作原理如图所示.

①该电池a电极上发生的电极反应式CH3OCH3+3H2O-12e-=2CO2+12H+.
②如果用该电池作为电解装置,当有23g二甲醚发生反应时,则理论上提供的电量表达式为0.5mol×12×1.6×10-19C×6.02×1023
mol-1C (1个电子的电量为1.6×10-19C).
