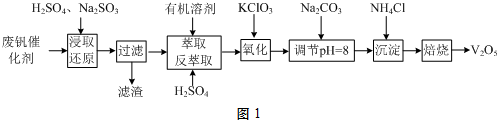
题目内容
8. 欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
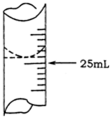
欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:(1)若甲同学在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗HCl标准溶液的体积为23.80mL.
(2)乙学生做了2组平行实验,数据记录如下:
| 实验序号 | 待测NaOH溶液的体积/mL | HCl标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 20.10 |
| 2 | 25.00 | 1.50 | 21.40 |
分析 (1)根据滴定管的精确度为0.01mL;
(2)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$计算,V(标准)用2次的平均值;在NaOH溶液中酚酞为红色,滴定终点时未无色;
解答 解:(1)记录滴定前滴定管内液面读数为1.10mL,滴定后液面如右图为24.90ml,滴定管中的液面读数为24.90ml-1.100ml=23.80mL,
故答案为:23.80;
(2)标准液消耗的体积V(标准)=$\frac{20.10+21.40-1.50}{2}$mL=20.00ml;根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$=$\frac{0.1000×0.020}{0.025}$mol/L=0.0800mol•L-1;滴定终点时,滴入最后一滴盐酸,溶液有红色变为无色,且半分钟不恢复红色,即为滴定终点,
故答案为:0.0800;滴入最后一滴盐酸,溶液有红色变为无色,且半分钟不恢复红色.
点评 本题考查了的使用、滴定计算、达到终点判断、中和滴定中的误差分析,题目难度不大.

练习册系列答案
相关题目
4.下列微粒不具有氧化性的是( )
| A. | Cl2 | B. | Cl- | C. | H+ | D. | Fe3+ |
19. 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图,从下表中选出
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图,从下表中选出
正确选项 ( )
 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图,从下表中选出
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图,从下表中选出正确选项 ( )
| 锥形瓶中的液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| ① | 碱 | 酸 | 石蕊 | (乙) |
| ② | 酸 | 碱 | 酚酞 | (甲) |
| ③ | 碱 | 酸 | 酚酞 | (甲) |
| ④ | 酸 | 碱 | 酚酞 | (乙) |
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
3.下列实验中不能观察到明显现象的是( )
| A. | 少量的氯水加入到盛有NaBr溶液的试管中 | |
| B. | 取一小片铝,砂纸除去氧化膜,放入试管中,加入少量2mL水 | |
| C. | 将锌片与铜片用导线连接,插入盛稀硫酸的烧杯中 | |
| D. | 向盛有过氧化氢水溶液的试管中,加入少量1mol/LFeCl3溶液 |
13.图是炭和水蒸汽发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应.下列说法不正确的是( )


| A. | 步骤1为吸热反应,步骤2为放热反应 | |
| B. | E2>E3>E1 | |
| C. | 1mol C发生该反应时吸收的能量为E3-E1 | |
| D. | E2-E1<E2-E3 |