题目内容
4.下列微粒不具有氧化性的是( )| A. | Cl2 | B. | Cl- | C. | H+ | D. | Fe3+ |
分析 处于最高价的微粒具有氧化性,处于最低价的微粒具有还原性,处于中间价态的微粒既有氧化性又有还原性,以此来解答.
解答 解:A.Cl2中Cl元素的化合价为0,为中间价态,有氧化性,故A不选;
B.Cl-中Cl元素的化合价为-1价,为最低价,只具有还原性,故B选;
C.H+中H元素的化合价为+1价,为最高价,只具有氧化性,故C不选;
D.Fe3+中Fe元素的化合价为+3价,为最高价,只具有氧化性,故D不选;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价与微粒性质的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
15.某同学做如表实验:下列说法正确的是( )
| 装 置 | 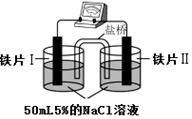 | 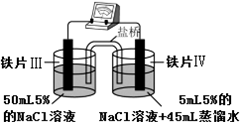 |
| 现象 | 电流计指针未发生偏转 | 电流计指针发生偏转 |
| A. | “电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀 | |
| B. | 铁片Ⅳ的电极反应式可能为Fe-3e-=Fe3+ | |
| C. | 用K3Fe(CN)6]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断装置的正、负极 | |
| D. | 铁片Ⅰ、Ⅲ所处的电解质溶液浓度相同,所以二者的腐蚀速率相等 |
12.下列物质属于硅酸盐的是( )
| A. | 二氧化硅 | B. | 保鲜膜 | C. | 青花瓷 | D. | 金刚石 |
19.化学源于生活,同时又服务于生活.以下做法不合理的是( )
| A. | 用食醋除去暖水瓶中的薄层水垢 | |
| B. | 一般不用纯碱代替小苏打作食品发酵粉 | |
| C. | 用甲醛溶液浸泡海产品以保鲜 | |
| D. | 用灼烧并闻气味的方法区别纯棉织物和纯毛织物 |
9.己知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高.则下列溶液沸点最高的是( )
| A. | 0.03mol•L-1的蔗糖溶液 | B. | 0.03mol•L-1的BaCl2溶液 | ||
| C. | 0.04mol•L-1的NaCl溶液 | D. | 0.02mol•L-1的CH3COOH溶液 |
8.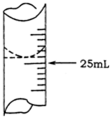 欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
(1)若甲同学在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗HCl标准溶液的体积为23.80mL.
(2)乙学生做了2组平行实验,数据记录如下:
据此计算出待测NaOH溶液的物质的量浓度为0.0800 mol•L-1(小数点后保留四位);乙同学判断达到滴定终点时的现象为滴入最后一滴盐酸,溶液有红色变为无色,且半分钟不恢复红色.
 欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:(1)若甲同学在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗HCl标准溶液的体积为23.80mL.
(2)乙学生做了2组平行实验,数据记录如下:
| 实验序号 | 待测NaOH溶液的体积/mL | HCl标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 20.10 |
| 2 | 25.00 | 1.50 | 21.40 |
 以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:
以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验: