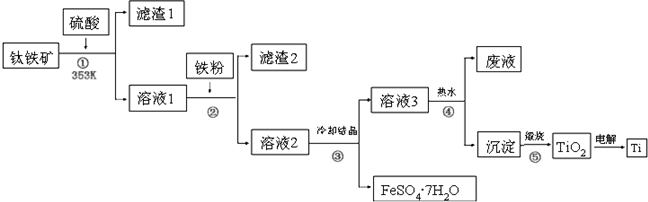
题目内容
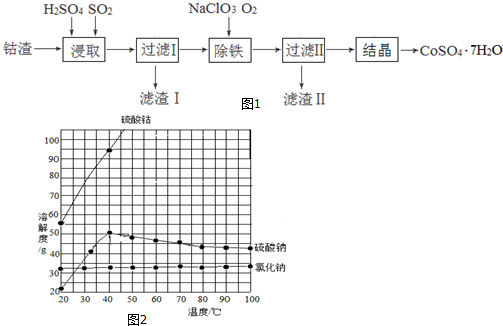
1.近日,一家中国企业并购了刚果(金)大型铜钴矿.据媒体分析,中国是钴消费大国,但钴资源贫乏,为获取钴资源是此次收购的重要原因.钴是制造锂电池不可或缺的原料,硫酸钴晶体可用于制造碱性电池、生产含钴颜料和其它钴产品.利用钴渣[含Co(OH)3、Fe(OH)3]制备硫酸钴晶体( CoSO4•7H2O)的工艺流程如图1: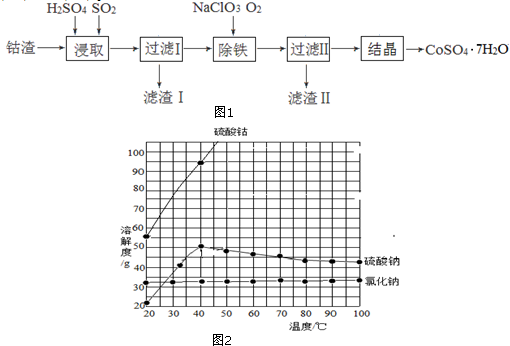
已知:有关物质的溶解度随温度变化关系如图2:
(1)均速向钴渣和稀硫酸的化合物中通入SO2,使Co(OH)3、Fe(OH)3被充分浸取,其中浸取Co(OH)3的离子方程式为2Co(OH)3+2H++SO2=2Co2++SO42-+4H2O;SO2的另一个作用为搅拌,加快浸取速率.
(2)除铁过程中,若选用氧化性更强的NaClO除铁,可能造成的后果是氧化性过强,会Co2+使被氧化.
(3)滤渣Ⅱ的成分为Fe(OH)3;通过除铁后溶液的pH降低(升高、降低或不变).
(4)过滤Ⅱ得到的滤液经过蒸发浓缩、趁热过滤、冷却到40℃结晶操作得到CoSO4•7H2O粗产品.冷却到40℃结晶的原因是防止析出硫酸钠晶体.
分析 利用钴渣[含Co(OH)3、Fe(OH)3]制备硫酸钴晶体( CoSO4•7H2O)的工艺流程:均速向钴渣和稀硫酸的化合物中通入SO2,发生2Co(OH)3+2H++SO2=2Co2++SO42-+4H2O,使Co(OH)3、Fe(OH)3被充分浸取,同时通入二氧化硫会使溶液中液体不停地运动,起到搅拌的作用,从而加快反应速率,过滤得到滤渣1为铜,加入氯酸钠、通入氧气,除铁,铁元素以氢氧化铁的形式沉淀,滤渣Ⅱ的成分为Fe(OH)3,过滤Ⅱ得到的滤液经过蒸发浓缩、趁热过滤冷却到40℃结晶操作得到CoSO4•7H2O粗产品.
(1)二氧化硫具有还原性,+3价的钴具有氧化性,浸取Co(OH)3的反应为+4价硫和+3价的钴间的氧化还原反应,根据离子反应方程式书写方法书写,二氧化硫气体通入溶液中,能起搅拌作用,能加快浸取速率;
(2)Co2+具有还原性,除铁过程中,若选用氧化性更强的NaClO除铁,可造成Co2+被氧化;
(3)铁元素以氢氧化铁的形式沉淀,形成氢氧化铁沉淀需消耗氢氧根离子,溶液的PH降低;
(4)从溶液中得到固体应蒸发浓缩、结晶,然后过滤,溶液含有溶质有硫酸钴、硫酸钠、氯化钠,冷却到40℃结晶目的防止析出硫酸钠晶体杂质.
解答 解:(1)二氧化硫具有还原性,Co3+具有氧化性,均速向钴渣和稀硫酸的化合物中通入SO2,使Co(OH)3、Fe(OH)3被充分浸取,实际是利用二氧化硫的还原性,使Co3+还原成Co2+,使Fe3+还原成Fe2+,所以浸取Co(OH)3的离子方程式为:2Co(OH)3+2H++SO2=2Co2++SO42-+4H2O,通入二氧化硫会使溶液中液体不停地运动,起到搅拌的作用,从而加快反应速率,
故答案为:2Co(OH)3+2H++SO2=2Co2++SO42-+4H2O;搅拌,加快浸取速率;
(2)次氯酸钠的氧化性过强,除铁过程中,若选用氧化性更强的NaClO除铁,可能会使Co2+被氧化成Co3+,
故答案为:氧化性过强,会Co2+使被氧化;
(3)除铁是把铁变成了氢氧化铁,过滤时,得到的滤渣为氢氧化铁,生成的氢氧化铁沉淀时要消耗溶液中的氢氧根离子,溶液的PH降低,
故答案为:Fe(OH)3;降低;
(4)从溶液中得到固体应首先蒸发浓缩、结晶,然后过滤,该溶液含有溶质有硫酸钴、硫酸钠、氯化钠,由溶解度曲线可知,氯化钠、硫酸钠溶解度在高温时,随温度变化小,而硫酸钴的变化大,在低于40度时,硫酸钠、硫酸钴的溶解度随温度变化都较大,在加热时浓缩时,高温下,氯化钠、硫酸钠溶解度小,它们会首先析出,硫酸钴的溶解度大,不能析出,趁热过滤可除去一部分硫酸钠晶体,氯化钠,在冷却结晶,此时的主要是硫酸钴晶体,当温度低于40度时,硫酸钠晶体也析出,
故答案为:蒸发浓缩、趁热过滤;防止析出硫酸钠晶体.
点评 本题考查硫酸钴晶体的制备,掌握氧化还原、物质的分离与提纯相关知识是解答关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案①NO(g)+Br2(g)?NOBr2(g)慢
②NO(g)+NOBr2(g)?2NOBr(g)快
下列有关该反应的说法正确的是( )
| A. | 反应速率主要取决于反应②的快慢 | B. | 反应速率v(NO)=v(NOBr)=2v(Br2) | ||
| C. | NOBr2是该反应的催化剂 | D. | 该反应的焓变等于akJ•mol-1 |
下表是25℃时某些盐的浓度积常数:
| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒
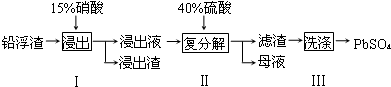
(2)步骤I有NO产生,浸出液中含量最多的金属阳离子为 Pb2+,写出Pb参加反应的化学方程式3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O,为防止Ag被溶解进入溶液,步骤I操作时应注意控制硝酸的用量并使Pb稍有剩余.
(3)母液可循环利用于步骤I,其溶质主要是HNO3(填一种物质化学式),若母液中残留的 SO42-过多,循环利用时可能出现的问题是浸出时部分Pb2+生成PbSO4随浸出渣排出,降低PbSO4的产率.
(4)粗PbSO4 产品含有的杂质是CaSO4,需用Pb(NO3)2溶液多次洗涤,以得到纯净的PbSO4.
(5)铅蓄电池放电时正极的电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O.如果用铅蓄电池做电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.80L,电解前硫酸溶液浓度为4.50mol•L-1,当制得4.48LCl2时(在标准状况下),求理论上电解后电池中硫酸溶液的浓度为(假设电解前后硫酸溶液的体积不变)4 mol•L-1.
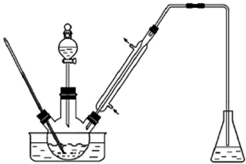 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.
步骤3:有机相用10%NaHCO3溶液洗涤,再加入适量无水MgSO4固体,放置一段时间后过滤;
步骤4:减压蒸馏有机相,收集相应馏分.
(1)实验装置中可能的错误有锥形瓶内可能会发生倒吸、胶塞可能被有机物腐蚀,冷凝管进水口是a;
(2)有同学建议将装置中温度计换成搅拌棒,那么温度计应移到什么地方使用水浴中;
(3)步骤2后续操作是搅拌、静置、分液;
(4)步骤3中用10%NaHCO3溶液洗涤的具体操作是在分液漏斗中将有机相与小苏打溶液充分振荡再分液,重复二到三次,加入无水MgSO4固体的作用是除去有机相的水.
(5)步骤4中采用蒸馏分离,请你预测蒸馏温度应先选择约D℃,再选择约E℃.
A.50 B.100 C.150 D.200 E.250 F.300.
| A. | H2O(g)=H2(g)+$\frac{1}{2}$ O2(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)=2H2O (l)△H=-484 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$ O2(g)=H2O (g)△H=-242 kJ | D. | 2H2(g)+O2(g)=2H2O (g)△H=+484 kJ/mol |
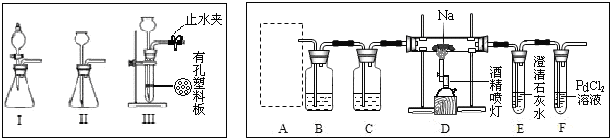
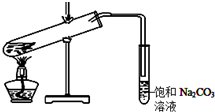 某学生做乙酸乙酯的制备实验装置如图所示.
某学生做乙酸乙酯的制备实验装置如图所示.