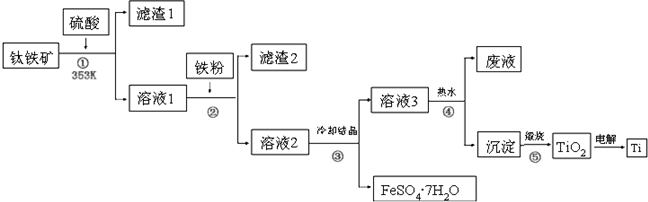
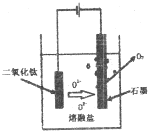
题目内容
6.临床上需$\frac{1}{6}$mol/L乳酸钠(NaC3H5O3)溶液600mL,如用112g/L乳酸钠针剂(20mL/支)配制,需几支?分析 乳酸的摩尔质量为112g/mol,则112g/L乳酸钠物质的量浓度C=1mol/L,溶液稀释过程中溶质的物质的量不变计算解答.
解答 解:乳酸的摩尔质量为112g/mol,则112g/L乳酸钠物质的量浓度C=1mol/L,临床上需$\frac{1}{6}$mol/L乳酸钠(NaC3H5O3)溶液600mL,设需要112g/L乳酸钠针剂(20mL/支)x支,依据溶液稀释过程中溶质的物质的量不变得:$\frac{1}{6}$mol/L×600mL=1mol/L×(20x)mL,解得x=5.
故答案为:5.
点评 本题考查了有关物质的量浓度计算,熟悉物质的量浓度概念及溶液稀释规律是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下表为元素周期表中的一部分,表中列出8种元素在周期表中的位置,按要求回答下列问题.
(1)在①~⑧元素中化学性质最不活泼的元素的名称是氩,金属性最强的元素的名称是钠.
(2)③、④、⑥三种元素中的原子半径最小的是O(填元素符号).
(3)①、②、③三种元素形成的离子,离子半径由大到小的顺序是Na+>Mg2+>Al3+(用离子符号填写).
(4)④与⑥形成的化合物的电子式为 .
.
(5)④与氢形成含氢量最高的化合物的结构式 .
.
(6)写出①和③两种元素的最高价氧化物对应的水化物相互反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(7)写出①、⑥和氢元素形成既含离子键又含共价键的化合物的电子式: ,形成的晶体是离子晶体.
,形成的晶体是离子晶体.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑥ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ |
(2)③、④、⑥三种元素中的原子半径最小的是O(填元素符号).
(3)①、②、③三种元素形成的离子,离子半径由大到小的顺序是Na+>Mg2+>Al3+(用离子符号填写).
(4)④与⑥形成的化合物的电子式为
 .
.(5)④与氢形成含氢量最高的化合物的结构式
 .
.(6)写出①和③两种元素的最高价氧化物对应的水化物相互反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(7)写出①、⑥和氢元素形成既含离子键又含共价键的化合物的电子式:
 ,形成的晶体是离子晶体.
,形成的晶体是离子晶体.
14.除去下列物质中少量杂质(括号内为杂质),所用试剂或方法错误的是( )
| A. | NaCl固体(KNO3)溶解配成热饱和溶液、降温结晶 | |
| B. | CO(水蒸气)通过浓硫酸的洗气瓶 | |
| C. | CaO固体(CaCO3)高温煅烧 | |
| D. | KCl固体(MnO2)溶解、过滤、蒸发 |
11.已知在101kPa,25℃条件下,2mol氢气燃烧生成水蒸气放出484kJ的热量,下列热化学方程式正确的是( )
| A. | H2O(g)=H2(g)+$\frac{1}{2}$ O2(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)=2H2O (l)△H=-484 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$ O2(g)=H2O (g)△H=-242 kJ | D. | 2H2(g)+O2(g)=2H2O (g)△H=+484 kJ/mol |
18.在一定条件下,发生反应:2X(g)+Y(g)?Z(g)△H=-197kJ•mol-1,若将2mol X和1mol Y充入2L的恒容密闭容器中,反应10min,测得X的物质的量为1.4mol,下列说法正确的是( )
| A. | 10min内,反应放出的热量为197kJ热量 | |
| B. | 10min内,X的平均反应速率为0.06mol•L-1•min-1 | |
| C. | 第10min时,Y的反应速率小于0.015mol•L-1•min-1(假如体系温度不变) | |
| D. | 第10min时,Z浓度为0.6mol•L-1 |
16.NA表示阿伏伽德罗常数,下列说法正确的是( )
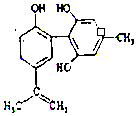

| A. | 标准状况下,22.4L HF中含有氟原子数目为NA | |
| B. | 0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+) | |
| C. | 1mol 如图物质与浓溴水反应时通常最多消耗Br2为6mol | |
| D. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |