题目内容
5.氢气燃烧的能量变化示意图如下,下列说法正确的是( )
| A. | H2O分子中H-O的键能为462kJ?mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-480 kJ?mol-1 | |
| C. | H2的燃烧热为240 kJ?mol-1 | |
| D. | 欲分解2molH2O(l),至少需要提供4×462kJ的热量 |
分析 A.根据H原子与O原子形成化学键的键能计算;
B.H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=(436kJ•mol-1+$\frac{1}{2}$496kJ•mol-1)-2×(462kJ•mol-1);
C.1mol氢气燃烧生成液态水,放出的热量为燃烧热;
D.由示意图可知,欲分解2 mol H2O(g),至少需要提供4×462 kJ的热量.
解答 解:A.由图中数据可知,形成1molH-O时放出462kJ能量,所以H2O分子中H-O的键能为462kJ?mol-1,故A正确;
B.H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=(436kJ•mol-1+$\frac{1}{2}$×496kJ•mol-1)-2×(462kJ•mol-1)=-240kJ•mol-1,故B错误;
C.H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-240kJ•mol-1,反应生成的水为气态水,不是燃烧热,故C错误;
D.由示意图可知,欲分解2 mol H2O(g),至少需要提供4×462 kJ的热量,分解2molH2O(l)需要的能量无法计算,故D错误;
故选A.
点评 本题考查了热化学方程式、反应热的计算,题目难度中等,注意把握键能与反应热的关系,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
13.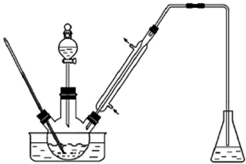 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经H2SO4干燥过的液溴,保温反应一段时间,冷却.
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.
步骤3:有机相用10%NaHCO3溶液洗涤,再加入适量无水MgSO4固体,放置一段时间后过滤;
步骤4:减压蒸馏有机相,收集相应馏分.
(1)实验装置中可能的错误有锥形瓶内可能会发生倒吸、胶塞可能被有机物腐蚀,冷凝管进水口是a;
(2)有同学建议将装置中温度计换成搅拌棒,那么温度计应移到什么地方使用水浴中;
(3)步骤2后续操作是搅拌、静置、分液;
(4)步骤3中用10%NaHCO3溶液洗涤的具体操作是在分液漏斗中将有机相与小苏打溶液充分振荡再分液,重复二到三次,加入无水MgSO4固体的作用是除去有机相的水.
(5)步骤4中采用蒸馏分离,请你预测蒸馏温度应先选择约D℃,再选择约E℃.
A.50 B.100 C.150 D.200 E.250 F.300.
 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.
步骤3:有机相用10%NaHCO3溶液洗涤,再加入适量无水MgSO4固体,放置一段时间后过滤;
步骤4:减压蒸馏有机相,收集相应馏分.
(1)实验装置中可能的错误有锥形瓶内可能会发生倒吸、胶塞可能被有机物腐蚀,冷凝管进水口是a;
(2)有同学建议将装置中温度计换成搅拌棒,那么温度计应移到什么地方使用水浴中;
(3)步骤2后续操作是搅拌、静置、分液;
(4)步骤3中用10%NaHCO3溶液洗涤的具体操作是在分液漏斗中将有机相与小苏打溶液充分振荡再分液,重复二到三次,加入无水MgSO4固体的作用是除去有机相的水.
(5)步骤4中采用蒸馏分离,请你预测蒸馏温度应先选择约D℃,再选择约E℃.
A.50 B.100 C.150 D.200 E.250 F.300.
20.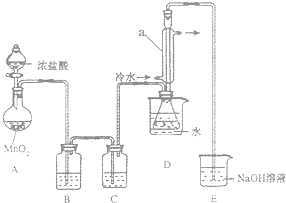 S2Cl2是一种金黄色易挥发的液体,常用作橡胶硫化剂.某化学兴趣小组 拟设计实验制备少量的S2Cl2,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化 合价升高,另一部分化合价降低).加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2Cl2,反应的化学方程式为:2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.
S2Cl2是一种金黄色易挥发的液体,常用作橡胶硫化剂.某化学兴趣小组 拟设计实验制备少量的S2Cl2,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化 合价升高,另一部分化合价降低).加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2Cl2,反应的化学方程式为:2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.
反应涉及的几种物质的熔沸点如下:
该小组设计的制备装置如图(夹持仪器已略去).
回答下列问题:
(1)连接好实验装置后的第一步实验操作是检查装置的气密性;
(2)实验中需要加热的仪器是AD(填写字母)
(3)装置B、C中的试剂分别是饱和食盐水、浓硫酸;
(4)装置D中仪器a的作用是冷凝回流、导气;
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏;
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑;
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气体产生.用离子方程式表示产生该现象的原因ClO-+2H++Cl-=Cl2↑+H2O.
 S2Cl2是一种金黄色易挥发的液体,常用作橡胶硫化剂.某化学兴趣小组 拟设计实验制备少量的S2Cl2,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化 合价升高,另一部分化合价降低).加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2Cl2,反应的化学方程式为:2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.
S2Cl2是一种金黄色易挥发的液体,常用作橡胶硫化剂.某化学兴趣小组 拟设计实验制备少量的S2Cl2,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化 合价升高,另一部分化合价降低).加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2Cl2,反应的化学方程式为:2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.反应涉及的几种物质的熔沸点如下:
| 物质 | S | S2Cl2 |
| 沸点/℃ | 445 | 138 |
| 熔点/℃ | 113 | -76 |
回答下列问题:
(1)连接好实验装置后的第一步实验操作是检查装置的气密性;
(2)实验中需要加热的仪器是AD(填写字母)
(3)装置B、C中的试剂分别是饱和食盐水、浓硫酸;
(4)装置D中仪器a的作用是冷凝回流、导气;
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏;
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑;
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气体产生.用离子方程式表示产生该现象的原因ClO-+2H++Cl-=Cl2↑+H2O.
17.下表为元素周期表中的一部分,表中列出8种元素在周期表中的位置,按要求回答下列问题.
(1)在①~⑧元素中化学性质最不活泼的元素的名称是氩,金属性最强的元素的名称是钠.
(2)③、④、⑥三种元素中的原子半径最小的是O(填元素符号).
(3)①、②、③三种元素形成的离子,离子半径由大到小的顺序是Na+>Mg2+>Al3+(用离子符号填写).
(4)④与⑥形成的化合物的电子式为 .
.
(5)④与氢形成含氢量最高的化合物的结构式 .
.
(6)写出①和③两种元素的最高价氧化物对应的水化物相互反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(7)写出①、⑥和氢元素形成既含离子键又含共价键的化合物的电子式: ,形成的晶体是离子晶体.
,形成的晶体是离子晶体.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑥ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ |
(2)③、④、⑥三种元素中的原子半径最小的是O(填元素符号).
(3)①、②、③三种元素形成的离子,离子半径由大到小的顺序是Na+>Mg2+>Al3+(用离子符号填写).
(4)④与⑥形成的化合物的电子式为
 .
.(5)④与氢形成含氢量最高的化合物的结构式
 .
.(6)写出①和③两种元素的最高价氧化物对应的水化物相互反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(7)写出①、⑥和氢元素形成既含离子键又含共价键的化合物的电子式:
 ,形成的晶体是离子晶体.
,形成的晶体是离子晶体.
14.除去下列物质中少量杂质(括号内为杂质),所用试剂或方法错误的是( )
| A. | NaCl固体(KNO3)溶解配成热饱和溶液、降温结晶 | |
| B. | CO(水蒸气)通过浓硫酸的洗气瓶 | |
| C. | CaO固体(CaCO3)高温煅烧 | |
| D. | KCl固体(MnO2)溶解、过滤、蒸发 |
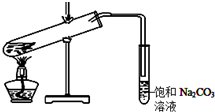 某学生做乙酸乙酯的制备实验装置如图所示.
某学生做乙酸乙酯的制备实验装置如图所示.