题目内容
12. 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.①CO可用于炼铁,已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1.
②CO与O2设计成燃料电池(以KOH溶液为电解液).该电池的负极反应式为CO+4OH--2e-=CO32-+2H2O.
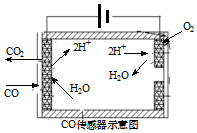
③测量汽车尾气中的CO浓度常用电化学气敏传感器,可用图简单表示,则阳极发生的电极反应为CO+H2O-2e-═CO2+2H+.
分析 ①依据热化学方程式和盖斯定律计算得到所需热化学方程式,①-②×3得到所需热化学方程式;
②CO-O2燃料电池(以KOH溶液为电解液),依据原电池原理,负极失电子发生氧化反应,燃料在负极失电子发生氧化反应;
③依据电解原理分析,阳极是失电子发生氧化反应的物质,结合图示可知是一氧化碳失电子生成二氧化碳.
解答 解:①由①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
依据盖斯定律①-②×3得到热化学方程式为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
②CO-O2燃料电池(以KOH溶液为电解液),一氧化碳在负极失电子发生氧化反应生成二氧化碳在溶液中生成碳酸钾,原电池负极电极反应为:CO+4OH--2e-=CO32-+2H2O,
故答案为:CO+4OH--2e-=CO32-+2H2O;
③阳极是失电子发生氧化反应的物质,结合图示可知是一氧化碳失电子生成二氧化碳同时生成氢离子,电极反应为:CO+H2O-2e-=CO2+2H+,
故答案为:CO+H2O-2e-═CO2+2H+.
点评 本题考查了热化学方程式书写、原电池、电解池工作原理,题目难度中等,注意掌握盖斯定律的内容及应用方法,明确原电池和电解池工作原理,试题有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
3.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 16gO2和O3的混合物中O原子的电子数为8NA | |
| B. | 标准状况下,2.24L氯气与水反应,转移的电子数为0.1NA | |
| C. | 28g乙烯与丙烯混合物中含有C-H键的数目为4NA | |
| D. | 常温下,1LpH=11的Na2CO3溶液中由水电离出H+的数目为0.001NA |
20.下列关于氯水的叙述,正确的是( )
| A. | 氯水中起漂白作用的是氯气分子 | |
| B. | 向氯水中加入NaHCO3粉末,无明显现象 | |
| C. | 与久置氯水不同,在新制氯水中加入硝酸银溶液后无白色沉淀 | |
| D. | 新制的氯水可使有色布条、品红溶液、石蕊试液等褪色 |
7.下列实验操作完全正确的是( )
| 编号 | 实验 | 操作 |
| A | 钠与水的反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 制取Fe(OH)3胶体 | 往盛有沸水的烧杯中滴加饱和FeCl3溶液,继续煮沸并用玻璃棒不断搅拌 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体分液漏斗上端管口倒出 |
| A. | A | B. | B | C. | C | D. | D |
17.25℃时,对于浓度均为0.1mol/L的三种溶液:①CH3COOH溶液、②NaOH溶液、③CH3COONa溶液,下列说法错误的是( )
| A. | ①和②等体积混合后的溶液中:c(OH-)═c(H+)+c(CH3COOH) | |
| B. | ①和③等体积混合后溶液显酸性:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | ②和③等体积混合后溶液中由水电离出的c(H+)<10-7 mol/L | |
| D. | 由水电离出的c(OH-):②>③>① |
4.下列说法不正确的是( )
| A. | 葡萄糖溶液能产生丁达尔效应 | |
| B. | 为除去乙醇中混有的少量乙酸,可加足量生石灰后再蒸馏 | |
| C. | 乙烯使溴的四氯化碳溶液褪色的原因是乙烯和溴发生了加成反应 | |
| D. | 粮食酿造的酒在一定温度下密闭储存会变得更醇香,是因为生成了酯类物质 |
10.有关热稳定性强弱的比较,不正确的是( )
| A. | KClO3<KCl | B. | K2MnO4>KMnO4 | C. | NaHCO3>Na2CO3 | D. | CaCO3<CaO |