题目内容
2.已知一元弱酸浓度c(HA)=0.010mol•L-1,常温下测得其PH=4.50,求该HA的K${\;}_{a}^{Θ}$与a.分析 HA是一元弱酸,在溶液中部分电离:HA?H++A-,0.01mol/L的HA溶液中pH=4.50,则溶液中c(H+)=10-4.5mol/L,而HA电离出的c(A-)≈c(H+)=10-4.5mol/L,据此分析.
解答 解:HA是一元弱酸,在溶液中部分电离:HA?H++A-,0.01mol/L的HA溶液中pH=4.50,则溶液中c(H+)=10-4.5mol/L,而HA电离出的c(A-)≈c(H+)=10-4.5mol/L,则HA的K${\;}_{a}^{Θ}$=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$=$\frac{1{0}^{-4.5}mol/L×1{0}^{-4.5}mol/L}{0.01mol/L-1{0}^{-4.5}mol/L}$≈$\frac{1{0}^{-4.5}mol/L×1{0}^{-4.5}mol/L}{0.01mol/L}$=10-7.
答:HA的K${\;}_{a}^{Θ}$为10-7.
点评 本题考查了酸溶液中酸的电离平衡常数的计算,根据一元弱酸电离出的氢离子浓度约等于酸根离子浓度来分析,难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
14.有关2L 0.1mol/L K2SO4溶液的叙述正确的是( )
| A. | 含有0.1 mol K2SO4 | |
| B. | 水的体积为2L | |
| C. | K+的物质的量浓度为0.2 mol/L | |
| D. | 取出1 L溶液后,浓度变为0.05 mol/L |
15.下列说法正确的是( )
| A. | 向容量瓶转移液体时,玻璃棒下端伸入到容量瓶刻度线以下 | |
| B. | 用玻璃棒蘸取CH3COOH溶液点在已湿润的pH试纸上,测定该溶液的pH | |
| C. | 用长颈漏斗分离出乙酸与乙醇反应的产物 | |
| D. | 测定中和热的实验中,应将酸、碱溶液一次性倒入量热装置中,并不断搅拌,待温度 稳定后记下温度 |
7.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)?N2(g)+2CO2(g),下列说法中不正确的是( )
| A. | NO的消耗速率等于CO2的生成速率时,反应不一定达到平衡 | |
| B. | CO的消耗速率是N2消耗速率的两倍时达到平衡 | |
| C. | 反应达到平衡后,NO的浓度等于CO2的浓度 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
14.下列溶液中,Cl-的物质的量浓度最大的是( )
| A. | 100mL 0.5mol•L-1AlCl3(aq) | B. | 200mL 0.5mol•L-1MgCl2(aq) | ||
| C. | 300mL 1mol•L-1NaCl(aq) | D. | 400mL 0.5mol•L-1BaCl2(aq) |
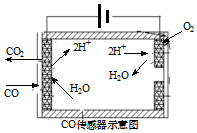 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.