题目内容
3.设NA为阿伏加德罗常数的值,下列说法不正确的是( )| A. | 16gO2和O3的混合物中O原子的电子数为8NA | |
| B. | 标准状况下,2.24L氯气与水反应,转移的电子数为0.1NA | |
| C. | 28g乙烯与丙烯混合物中含有C-H键的数目为4NA | |
| D. | 常温下,1LpH=11的Na2CO3溶液中由水电离出H+的数目为0.001NA |
分析 A.氧气和臭氧分子中都只含有O元素,根据n=$\frac{m}{M}$计算出混合物中含有O的物质的量,再计算出含有电子的物质的量;
B.氯气与水的反应中,只有部分氯气与水反应生成氯化氢和次氯酸;
C.乙烯和丙烯的最简式为CH2,每个H原子形成1个碳氢键,根据H的物质的量判断形成碳氢键的物质的量及数目;
D.碳酸钠溶液中,碳酸根离子水解促进了水的电离,溶液中氢氧根离子是水的电离的.
解答 解:A.16gO2和O3的混合物中含有16gO,含有氧原子的物质的量为:$\frac{16g}{16g/mol}$=1mol,1molO含有8mol电子,含有电子数为8NA,故A正确;
B.标准状况下2.244L氯气的物质的量为0.1mol,0.1mol氯气溶于水,只有少量氯气与水发生反应,所以转移电子的物质的量小于0.1mol,故B错误;
C.28g乙烯与丙烯的混合物中含有28g 最简式CH2,含有最简式CH2的物质的量为:$\frac{28g}{14g/mol}$=2mol,含有4molH原子,则含有碳氢键的物质的量为4mol,含有C-H键的数目为4NA,故C正确;
D.常温下,1LpH=11的Na2CO3溶液中氢氧根离子浓度为0.001mol/L,含有氢氧根离子的物质的量为0.001mol,该溶液中的氢氧根离子是水电离的,则由水电离出H+的数目为0.001NA,故D正确;
故选B.
点评 本题考查阿伏加德罗常数的计算与应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确最简式在化学计算中的应用,B为易错点,注意氯气与水的反应情况,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
15.下列说法正确的是( )
| A. | 向容量瓶转移液体时,玻璃棒下端伸入到容量瓶刻度线以下 | |
| B. | 用玻璃棒蘸取CH3COOH溶液点在已湿润的pH试纸上,测定该溶液的pH | |
| C. | 用长颈漏斗分离出乙酸与乙醇反应的产物 | |
| D. | 测定中和热的实验中,应将酸、碱溶液一次性倒入量热装置中,并不断搅拌,待温度 稳定后记下温度 |
14.下列溶液中,Cl-的物质的量浓度最大的是( )
| A. | 100mL 0.5mol•L-1AlCl3(aq) | B. | 200mL 0.5mol•L-1MgCl2(aq) | ||
| C. | 300mL 1mol•L-1NaCl(aq) | D. | 400mL 0.5mol•L-1BaCl2(aq) |
18.下列实验事实不能用平衡移动原理解释的是( )
| A. |  将NO2球浸泡在冷水中和热水中 | |||||||||||||
| B. | 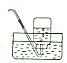 排饱和食盐水收集氯气 | |||||||||||||
| C. | 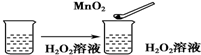 | |||||||||||||
| D. |
| |||||||||||||
8.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,64g SO2气体中所含分子数为NA | |
| B. | 标准状况下,4.48L四氯化碳中所含原子总数为NA | |
| C. | 1mol HNO3作氧化剂时转移电子数为3NA | |
| D. | 常温常压下,11.2L NO2中所含分子数为0.5NA |
1.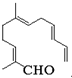 从甜橙的芳香油中可分离得到一种化合物,该化合物的结构简式如图,下列有关该化合物的说法正确的是( )
从甜橙的芳香油中可分离得到一种化合物,该化合物的结构简式如图,下列有关该化合物的说法正确的是( )
 从甜橙的芳香油中可分离得到一种化合物,该化合物的结构简式如图,下列有关该化合物的说法正确的是( )
从甜橙的芳香油中可分离得到一种化合物,该化合物的结构简式如图,下列有关该化合物的说法正确的是( )| A. | 可发生1,4-加成 | |
| B. | 与新制的Cu(OH)2悬浊液反应后得到饱和羧酸 | |
| C. | 1mol该有机物最多与含5molBr2的溴水发生加成 | |
| D. | 与H2反应时一定可得到饱和一元醇 |
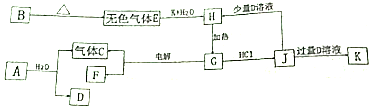
 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.