题目内容
8.(1)H2O2水溶液给称双氧水,医疗上利用它有杀菌消毒作用来清洗伤口,对下列A-C涉及H2O2的反应,填写下列空白:A、H2O2+Cl2═HCl+O2
B、H2O2+2I-+2H+═I2+2H2O
C、2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2
D、CaO+H2O=Ca(OH)2
①H2O2仅体现氧化性的反应是C(填代号,下同)
②H2O2既有氧化性又有还原性的是B
③H2O2仅体现还原性的是A
④H2O既无氧化性又无还原性的是D
(2)已知CuO具有氧化性,能够与NH3反应生成两种单质和H2O,请写出在加热条件下CuO与NH3反应的化学方程式3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O
(3)在一定条件下,RO3n-与Cl2反应如下:RO3n-+Cl2+2OH═RO42-+2Cl+H2O由以上反应可知上述过程中RO3n-被氧化(填“氧化”或“还原”),RO3n-元素R的化合价是+4.
分析 (1)①H202仅体现氧化性说明该反应中双氧水得电子化合价降低;
②H202既有氧化性又有还原性说明双氧水既得电子有失电子;
③H202仅体现还原性说明该反应中双氧水只失电子化合价升高;
④H2O既无氧化性又无还原性,说明水中各元素的化合价未变;
(2)加热条件下,CuO具有氧化性,能够与NH3反应生成两种单质和H20,该反应中Cu得电子化合价降低生成Cu、氨气中N元素失电子化合价升高生成氮气;
(3)该反应中Cl元素化合价由0价变为-1价,所以氯气是氧化剂,则RO3n-是还原剂被氧化,根据电荷守恒确定n,从而确定R元素化合价.
解答 解:(1)A、H2O2+Cl2=2HCl+O2↑中O元素化合价由-1价变为0价、Cl元素化合价由0价变为-1价,所以双氧水是还原剂,体现还原性;
B、H2O2+2I-+2H+=I2+2H2O中O元素化合价由-1价变为-2价、I元素化合价由-1价变为0价,所以双氧水是氧化剂,体现氧化性;
C、O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑中O元素化合价由-1价变为0价、-2价,所以双氧水既是氧化剂又是还原成,所以体现氧化性和还原性,
D、CaO+H2O=Ca(OH)2水中各元素的化合价未变,所以H2O既无氧化性又无还原性;
①H2O2仅体现氧化性的是C,故选C;
②H2O2既有氧化性又有还原性的是B;
③H2O2仅体现还原性的是A;
④H2O既无氧化性又无还原性的是D;
(2)加热条件下,CuO具有氧化性,能够与NH3反应生成两种单质和H20,该反应中Cu得电子化合价降低生成Cu、氨气中N元素失电子化合价升高生成氮气,反应方程式为3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O,
故答案为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O;
(3)该反应中Cl元素化合价由0价变为-1价,所以氯气是氧化剂,则RO3n-是还原剂被氧化,根据电荷守恒得n=2,则RO3n-中R元素化合价=6-2=+4,
故答案为:氧化;+4.
点评 本题考查氧化还原反应,涉及氧化性还原性判断、方程式的书写、化合价的判断等知识点,明确元素化合价变化与性质的关系即可解答,知道元素化合价判断方法,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案| A. | 含氧酸酸性R>X | B. | 简单氢化物稳定性Y<X | ||
| C. | 最高正化合价Z<X<Y<R | D. | 由Z和R形成的化合物为离子化合物 |
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3.
| A. | ①②③④ | B. | ②③④ | C. | ①③④ | D. | ②③ |
| A. | 二氧化硫用作食品防腐剂 | |
| B. | 明矾用于水的净化 | |
| C. | 盛放氢氧化钠溶液时,使用带橡皮塞的磨口瓶 | |
| D. | 在常温下用铝制贮罐贮运浓硫酸 |
| A. | 酸性:HIO4>HBrO4>HClO4 | B. | 原子半径:Na>Cl>S | ||
| C. | 碱性:KOH>NaOH>LiOH | D. | 金属性:Na>Al>Mg |
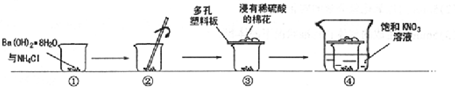
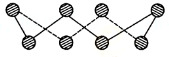 VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途.请回答下列问题:
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途.请回答下列问题: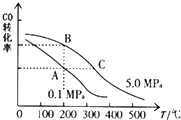 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题: