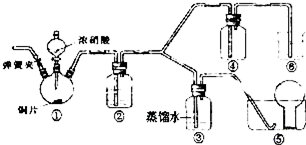
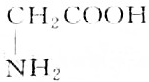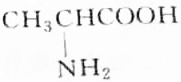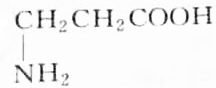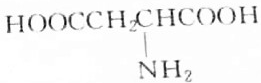题目内容
19.X、Y、Z、R是四种短周期主族元素,X原子最外层电子数是次外层的2倍,Y元素在地壳中含量最多,Z元素金属性最强,R原子的核外电子数是X、Z核外电子数之和,下列叙述一定正确的是( )| A. | 含氧酸酸性R>X | B. | 简单氢化物稳定性Y<X | ||
| C. | 最高正化合价Z<X<Y<R | D. | 由Z和R形成的化合物为离子化合物 |
分析 X、Y、Z、R是四种短周期主族元素,X原子最外层电子数是次外层的2倍,原子只能由2个电子层,最外层电子数为4,故X为C元素;Y元素在地壳中含量最多,则Y为O元素;Z元素金属性最强,则Z为Na;R原子的核外电子数是X、Z核外电子数之和,即R原子核外电子数为6+11=17,故R为Cl,结合元素周期律解答.
解答 解:X、Y、Z、R是四种短周期主族元素,X原子最外层电子数是次外层的2倍,原子只能由2个电子层,最外层电子数为4,故X为C元素;Y元素在地壳中含量最多,则Y为O元素;Z元素金属性最强,则Z为Na;R原子的核外电子数是X、Z核外电子数之和,即R原子核外电子数为6+11=17,故R为Cl.
A.碳酸的酸性比HClO的强,故A错误;
B.非金属性O>C,故简单氢化物稳定性H2O>CH4,故B错误;
C.氧元素一般没有最高正化合价,最高正化合价Z(Na)<X(C)<R(Cl),故C错误;
D.由Z和R形成的化合物为NaCl,由钠离子与氯离子构成,属于离子化合物,故D正确.
故选:D.
点评 本题考查结构性质物质关系应用,侧重对元素周期律的考查,A选项为易错点,学生容易忽略最高价含氧酸.

练习册系列答案
相关题目
9.下列有关问题与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干CuCl2溶液得到Cu(OH)2固体
⑥在含有Fe2+的FeCl3溶液中,要除去Fe2+,往往通入氧化剂Cl2.
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干CuCl2溶液得到Cu(OH)2固体
⑥在含有Fe2+的FeCl3溶液中,要除去Fe2+,往往通入氧化剂Cl2.
| A. | ①②③ | B. | ②③④⑤ | C. | ①④⑤⑥ | D. | ①②③④⑤ |
10.下列有关化学用语表示正确的是( )
| A. | 硫原子的结构示意图: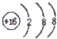 | B. | Na2S的电子式:Na+: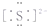 | ||
| C. | HCl的结构式:H-Cl | D. | CH4分子的球模型: |
14.C5H11(戊醇)发生下列反应时,所得有机产物结构种数最少(不考虑立体异构)的是( )
| A. | 与浓硫酸共热发生消去反应 | B. | 与浓氢溴酸发生卤代反应 | ||
| C. | 与氧气、铜发生催化氧化反应 | D. | 与草酸发生酯化反应 |
4.化学与人类生活、生产和社会可持续发展密切相关,下列说法正确的是( )
| A. | 为测定熔融氢氧化钠的导电性,可将氫氧化钠固体放在石英坩埚中加热熔化 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| C. | 铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝的冶炼方法比较简单 | |
| D. | 半导体行业中有一句话:“从沙滩到用户”,计箅机芯片的材料是经提纯的二氧化硅 |