题目内容
20. VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途.请回答下列问题:
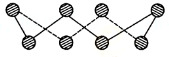
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途.请回答下列问题:(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是sp3;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为O>S>Se;
(3)Se原子序数为34,其核外M层电子的排布式为3s23p63d10;
(4)H2Se的酸性比H2S强(填“强”或“弱”).气态SeO3分子的立体构型为平面三角形,SO32-离子的立体构型为三角锥形;
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:第一步产生的H+抑制第二步电离;第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子;
②H2SeO4比 H2SeO3酸性强的原因:H2SeO3和H2SeO4可表示为 (HO)SeO2和 (HO)2SeO2.H2SeO3中Se为+4价,而H2SeO4中Se为+6价,正电性更高,导致Se-O-H中的O原子更向Se偏移,越易电离出H+.
分析 (1)根据图片知,每个S原子含有2个σ键和2个孤电子对,根据价层电子对互斥理论确定S原子杂化方式;
(2)同一主族元素,元素原子失电子能力随着原子序数的增大而增强,原子失电子能力越强,其第一电离能越小;
(3)Se元素34号元素,M电子层上有18个电子,分别位于3s、3p、3d能级上;
(4)非金属性越强的元素,其与氢元素的结合能力越强,则其氢化物在水溶液中就越难电离,酸性就越弱;
根据价层电子对互斥理论确定气态SeO3分子的立体构型、SO32-离子的立体构型;
(5)①酸第一步电离产生的酸根阴离子带有负电荷,由于异种电荷相互吸引,第一步产生的H+抑制第二步电离;
②H2SeO3的分子结构为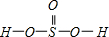 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为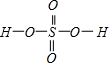 ,Se为+6价,后者Se原子吸电子能力强.
,Se为+6价,后者Se原子吸电子能力强.
解答 解:(1)根据图片知,每个S原子含有2个σ键和2个孤电子对,所以每个S原子的价层电子对个数是4,则S原子为sp3杂化,
故答案为:sp3;
(2)同一主族元素,元素原子失电子能力随着原子序数的增大而增强,原子失电子能力越强,其第一电离能越小,所以其第一电离能大小顺序是O>S>Se,
故答案为:O>S>Se;
(3)Se元素34号元素,M电子层上有18个电子,分别位于3s、3p、3d能级上,所以其核外M层电子的排布式为3s23p63d10,
故答案为:34;3s23p63d10;
(4)非金属性越强的元素,其与氢元素的结合能力越强,则其氢化物在水溶液中就越难电离,酸性就越弱,非金属性S>Se,所以H2Se的酸性比H2S强,气态SeO3分子中Se原子价层电子对个数是3且不含孤电子对,所以其立体构型为平面三角形,SO32-离子中S原子价层电子对个数=3+$\frac{1}{2}$(6+2-3×2)=4且含有一个孤电子对,所以其立体构型为三角锥形,
故答案为:强;平面三角形;三角锥形;
(5)①酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离,所以H2SeO4和H2SeO3第一步电离程度大于第二部电离程度,导致第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子,
故答案为:第一步产生的H+抑制第二步电离;第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子;
②H2SeO3的分子结构为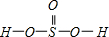 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为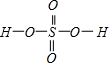 ,Se为+6价,后者Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+,
,Se为+6价,后者Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+,
故答案为:H2SeO3和H2SeO4可表示为 (HO)SeO2和 (HO)2SeO2.H2SeO3中Se为+4价,而H2SeO4中Se为+6价,正电性更高,导致Se-O-H中的O原子更向Se偏移,越易电离出H+.
点评 本题考查了较综合,涉及粒子空间构型判断、原子杂化方式判断、元素周期律等知识点,这些知识点都是高考高频点,根据价层电子对互斥理论、元素周期律等知识点来分析解答,注意(4)氢化物酸性强弱比较方法,为易错点,(5)注意把握含氧酸酸性强弱的判断方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 硫原子的结构示意图: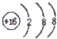 | B. | Na2S的电子式:Na+: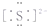 | ||
| C. | HCl的结构式:H-Cl | D. | CH4分子的球模型: |
| A. | 酒精与水以任意比互溶 | B. | 用纯碱洗涤油脂 | ||
| C. | 氨易溶于水 | D. | 用苯将溴水中的溴萃取出来 |
| 编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)③的元素符号是Li;⑧的元素名称是硼;①在元素周期表中的位置是第二周期第VIA族;
(2)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3
(3)用电子式表示②和⑤组成的化合物的形成过程
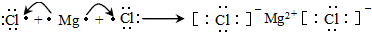 ;
;(4)写出⑦的最高价氧化物对应的水化物与它的氢化物发生反应的化学方程式NH3+HNO3=NH4NO3
(5)写出②的最高价氧化物对应的水化物跟⑤的氢化物水溶液发生反应的离子方程式Mg(OH)2+2H+=Mg2++2H2O;
(6)“神舟”十号载人飞船内需要一种化合物来吸收航天员呼出的CO2,你认为该物质应该由上表中的①⑥元素组成(填表中编号),用化学方程式表示吸收原理2Na2O2+2CO2=2Na2CO3+O2.
| A. | 常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO-)>c(Na+) | |
| B. | 1 mol•L-1的硫化钠溶液中,c(H+)+c(Na+)=c(OH-)+c(HS-)+c(S2-) | |
| C. | 稀释醋酸溶液,溶液中所有离子的浓度均降低 | |
| D. | pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-) |
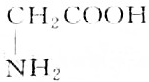
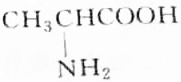
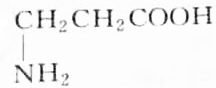
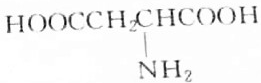
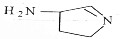 ,则分子中σ键与π键之比为14:1.
,则分子中σ键与π键之比为14:1.