题目内容
18.某同学设计如图的实验方案来探究NH4Cl与Ba(OH)2•8H2O反应中的能量变化.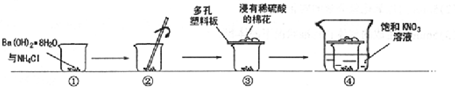
(1)小烧杯中发生反应的化学方程式是Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;
(2)欲检验该反应生成的气体,实验操作是在步骤②的烧杯口放一张湿润的红色石蕊试纸;步骤③中稀硫酸的作用是吸收氨气以防止污染;步骤④中溶液中产生的现象是白色晶体析出,产生此现象的原因是氢氧化钡与氯化铵反应吸热,硝酸钾的溶解度减小而析出晶体.
(3)由上述实验现象可知NH4Cl与Ba(OH)2•8H2O反应为吸热反应(填“吸热”或“放热”).说明该反应中反应物的总能量<生成物的总能量(填“>”、“<”或“=”).
分析 (1)氯化铵铵盐和强碱氢氧化钡反应生成氨气、水、以及氯化钡;
(2)氨气使湿润的红色石蕊试纸变蓝,据此解答即可.(3)当反应物的总能量小于生成物的总能量时,反应是吸热反应
解答 解:(1)氯化铵属于铵盐,能和强碱氢氧化钡反应生成氨气、水、以及氯化钡,化学方程式为:Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O,故答案为:Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;
(2)在步骤②的烧杯口放一张湿润的红色石蕊试纸,以便检验氨气的存在,氨气溶于水呈碱性,用稀硫酸吸收氨气以防止污染,硝酸钾的溶解度随着温度的降低明显下降,故应有白色晶体析出,故答案为:在步骤②的烧杯口放一张湿润的红色石蕊试纸;吸收氨气以防止污染;白色晶体析出;氢氧化钡与氯化铵反应吸热,硝酸钾的溶解度减小而析出晶体;(3)玻璃片上结冰而与小烧杯粘在一起,说明氢氧化钡和氯化铵的反应是吸热反应,即反应物的总能量小于生成物的总能量,故答案为:吸热;小于.
点评 本题考查学生常见的吸热反应和放热反应的有关知识,可以根据所学知识来回答,难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
8.下列各组物质中,分子中的所有原子都满足最外层8电子结构的是( )
①BeCl2、PF5 ②PCl3、N2 ③COCl2(光气)、SF6 ④XeF2、BF3 ⑤SO2、H2O2、HClO.
①BeCl2、PF5 ②PCl3、N2 ③COCl2(光气)、SF6 ④XeF2、BF3 ⑤SO2、H2O2、HClO.
| A. | ①② | B. | ③④ | C. | ② | D. | ⑤ |
9.下列有关问题与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干CuCl2溶液得到Cu(OH)2固体
⑥在含有Fe2+的FeCl3溶液中,要除去Fe2+,往往通入氧化剂Cl2.
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干CuCl2溶液得到Cu(OH)2固体
⑥在含有Fe2+的FeCl3溶液中,要除去Fe2+,往往通入氧化剂Cl2.
| A. | ①②③ | B. | ②③④⑤ | C. | ①④⑤⑥ | D. | ①②③④⑤ |
6.关于化学反应CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑的下列说法中,正确的是( )
| A. | 属于放热反应 | B. | 属于氧化还原反应 | ||
| C. | 由热能转化为化学能 | D. | 可用于工业生产熟石灰 |
13.室温下,用0.1g金属粉末与10mL酸溶液反应,在反应开始阶段,产生H2的速率最快的是( )
| 金属(粉末状) | 酸的浓度 | |
| A | Mg | 6 mol/L硝酸 |
| B | Zn | 3 mol/L硫酸 |
| C | Fe | 6 mol/L盐酸 |
| D | Cu | 6 mol/L硫酸 |
| A. | A | B. | B | C. | C | D. | D |
3.甲烷分子中的四个氢原子都被苯基取代,可得到的分子如图所示,对该分子的下列叙述中不正确的是( )
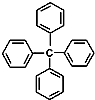

| A. | 分子式为C25H20 | |
| B. | 此物质的一氯代物有3种 | |
| C. | 此物质属芳香烃 | |
| D. | 此分子中所有原子可能处于同一平面上 |
10.下列有关化学用语表示正确的是( )
| A. | 硫原子的结构示意图: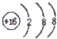 | B. | Na2S的电子式:Na+: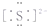 | ||
| C. | HCl的结构式:H-Cl | D. | CH4分子的球模型: |