题目内容
13.常温下,如果取0.1mol•L-1 HA溶液与0.1mol•L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:(1)混合溶液的pH=8的原因:A-+H2O?HA+OH-(用离子方程式表示).
(2)混合溶液中由水电离出的c(OH-)>(填“>”、“<”或“=”)0.1mol•L-1 NaOH溶液中由水电离出的 c(OH-).
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):c(OH-)-c(HA)=10-8 mol•L-1.
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH>7(填“>”、“<”或“=”);将同温度下等浓度的四种盐溶液NH4+按由大到小的顺序排列是CADB(填序号).
A.NH4HSO4 B.NH4A C.(NH4)2SO4 D.NH4Cl.
分析 常温下,等物质的量的HA和NaOH恰好反应生成NaA,混合溶液呈碱性,说明NaA为强碱弱酸盐,
(1)弱酸根离子水解导致NaA溶液呈碱性;
(2)混合溶液中水电离出的c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$、NaOH溶液中由水电离出的c(OH-)=c(H+);
(3)溶液中存在质子守恒,根据质子守恒计算;
(4)NH4A溶液为中性,说明HA电离程度和一水合氨电离程度相等,HA溶液加到Na2CO3溶液中有气体放出,说明HA酸性大于碳酸,据此判断(NH4)2CO3溶液酸碱性;离子促进了铵根离子的水解,硫酸氢铵电离出的氢离子抑制了铵根离子水解,硫酸铵中铵根离子浓度最大,据此进行判断.
解答 解:常温下,等物质的量的HA和NaOH恰好反应生成NaA,混合溶液呈碱性,说明NaA为强碱弱酸盐,则HA为弱酸,
(1)A-水解导致NaA溶液呈碱性,水解方程式为A-+H2O?HA+OH-,
故答案为:A-+H2O?HA+OH-;
(2)混合溶液中水电离出的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-8}}$mol/L=10-6mol/L、NaOH溶液中由水电离出的c(OH-)=c(H+)=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13mol/L,所以混合溶液中由水电离出的c(OH-)>0.1mol•L-1 NaOH溶液中由水电离出的c(OH-),
故答案为:
(3)根据质子守恒得:c(HA)+c(H+)=c(OH-),则c(OH-)-c(HA)=c(H+)=10-8mol/L,
故答案为:10-8;
(4)NH4A溶液为中性,说明HA电离程度和一水合氨电离程度相等,HA溶液加到Na2CO3溶液中有气体放出,说明HA酸性大于碳酸,即HA电离程度大于碳酸,所以铵根离子水解程度小于弱酸根离子,溶液呈碱性,则pH>7;
A.NH4HSO4溶液中,氢离子抑制了铵根离子的水解,则硫酸氢铵溶液中的铵根离子浓度大于氯化铵;
B.NH4A溶液中A-促进了铵根离子的水解,则该溶液中铵根离子浓度小于氯化铵;
C.(NH4)2SO4的化学式中含有2个铵根离子,铵根离子水解程度较小,则其溶液中铵根离子浓度最大;
D.NH4Cl中铵根离子正常水解;
根据分析可知,浓度相等的四种盐溶液NH4+按由大到小的顺序排列是:CADB,
故答案为:>;CADB.
点评 本题考查了酸碱混合的定性判断、离子浓度大小比较等知识,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电荷守恒、质子守恒及盐的水解原理的含义及应用方法,试题知识点较多、综合性较强,充分考查了学生的分析能力及灵活应用能力.


| A. | 分子式为C25H20 | |
| B. | 此物质的一氯代物有3种 | |
| C. | 此物质属芳香烃 | |
| D. | 此分子中所有原子可能处于同一平面上 |
| A. | 为测定熔融氢氧化钠的导电性,可将氫氧化钠固体放在石英坩埚中加热熔化 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| C. | 铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝的冶炼方法比较简单 | |
| D. | 半导体行业中有一句话:“从沙滩到用户”,计箅机芯片的材料是经提纯的二氧化硅 |
| A. | 定容时仰视刻度线 | |
| B. | 定容后摇匀、静置,发现液面低于刻度线,又加水至刻度线 | |
| C. | 烧杯中的溶液未冷却至室温就将溶液移到容量瓶中 | |
| D. | 容量瓶洗涤后仍有少量残留 |
| 编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)③的元素符号是Li;⑧的元素名称是硼;①在元素周期表中的位置是第二周期第VIA族;
(2)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3
(3)用电子式表示②和⑤组成的化合物的形成过程
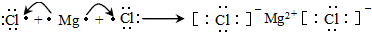 ;
;(4)写出⑦的最高价氧化物对应的水化物与它的氢化物发生反应的化学方程式NH3+HNO3=NH4NO3
(5)写出②的最高价氧化物对应的水化物跟⑤的氢化物水溶液发生反应的离子方程式Mg(OH)2+2H+=Mg2++2H2O;
(6)“神舟”十号载人飞船内需要一种化合物来吸收航天员呼出的CO2,你认为该物质应该由上表中的①⑥元素组成(填表中编号),用化学方程式表示吸收原理2Na2O2+2CO2=2Na2CO3+O2.
| A. | Pb是正极 | B. | PbO2得电子,被氧化 | ||
| C. | 负极反应是:Pb-2e-+SO42-=PbSO4 | D. | 电池放电时,溶液酸性增强 |