题目内容
3.某元素R的原子序数小于18,该元素的原子得到1个电子后形成具有稀有气体元素原子的电子层结构的离子,该元素可形成含氧酸HRO3,下列说法中正确的是( )①R元素的最高正价是+5价
②R元素还可形成其他含氧酸
③R元素原子的最外层电子数为7
④R元素的原子序数为7.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
分析 该元素的原子得到1个电子后形成具有稀有气体元素原子的电子层结构的离子,应为ⅦA族元素,该元素可形成含氧酸HRO3,则应为Cl元素,F无正价,以此解答该题.
解答 解:该元素的原子得到1个电子后形成具有稀有气体元素原子的电子层结构的离子,应为ⅦA族元素,该元素可形成含氧酸HRO3,则应为Cl元素,
①Cl元素的最高正价是+7价,故错误;
②Cl元素化合价有+1、+3、+5、+7价,还可形成其他含氧酸,故正确;
③Cl元素原子的最外层电子数为7,故正确;
④Cl元素的原子序数为17,故错误.
故选B.
点评 本题考查原子结构与元素周期律的关系,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握原子核外电子排布特点,注意元素周期律的递变规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.前不久,我国科学家合成了三种新核素,其中一种是${\;}_{72}^{185}$Hf.下列关于${\;}_{72}^{185}$Hf的叙述中,正确的是( )
| A. | 该元素的原子序数是72 | B. | 该元素的原子序数是113 | ||
| C. | 该核素的中子数为72 | D. | 该元素的相对原子质量为了185 |
14.能正确表示下列反应的离子方程式为( )
| A. | 向FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2=2Fe3++I2+4Br- | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 向FeCl3溶液中加入少量KSCN溶液:Fe3++3SCN-=Fe(SCN)3↓ |
11.下列原子中,半径最小的是( )
| A. | F | B. | Cl | C. | Al | D. | I |
18.下列物质的命名错误的是( )
| A. | 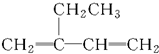 2-乙基-1,3-丁二烯 2-乙基-1,3-丁二烯 | B. | CH2=CH-CH2-CH3 1-丁烯 | ||
| C. | 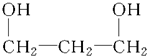 1,3-二丙醇 1,3-二丙醇 | D. | 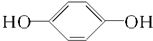 1,4-苯二酚 1,4-苯二酚 |
8.某短周期非金属元素,其原子核外最外层电子数是次外层电子数的一半,该元素( )
| A. | 在自然界中以化合态的形式存在 | B. | 单质常用作半导体材料 | ||
| C. | 最高价氧化物不与任何酸反应 | D. | 气态氢化物比甲烷稳定 |
15.下列分子或离子中,VSEPR模型名称与分子或离子的立体构型名称不一致的是( )
| A. | CO2 | B. | H2O | C. | CO32- | D. | CCl4 |
2.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选用酚酞作指示剂.请填写下列空白:
(1)酸式滴定管用蒸馏水洗涤后,直接注入标准盐酸溶液进行滴定,则测得的结果偏高(填“偏高”、“偏低”或“无影响”).
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(3)滴定结果如下表所示:
若盐酸标准溶液的浓度为0.1000mol•L-1,则该NaOH溶液的物质的量浓度为0.1044 mol•L-1.
(1)酸式滴定管用蒸馏水洗涤后,直接注入标准盐酸溶液进行滴定,则测得的结果偏高(填“偏高”、“偏低”或“无影响”).
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(3)滴定结果如下表所示:
| 滴定 次数 | 待测溶液NaOH的 体积/mL | 标准盐酸溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 30.30 |
| 3 | 25.00 | 0.22 | 26.31 |
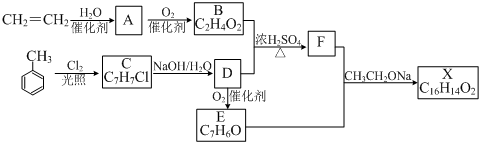
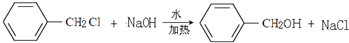 ,反应类型为水解反应或取代反应.
,反应类型为水解反应或取代反应.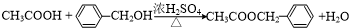 .
.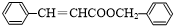 .
.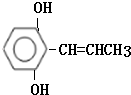 .
.