题目内容
5.等质量的下列物质燃烧,消耗氧气量最多的是( )| A. | CH4 | B. | C2H6 | C. | C3H6 | D. | C3H8 |
分析 由C~O2~CO2,4H~O2~2H2O可知,消耗1molO2,需要12gC,而消耗1molO2,需要4gH,可知等质量时,烃中氢元素质量分数越大,消耗的O2越多,以此进行比较.
解答 解:由C~O2~CO2,4H~O2~2H2O可知,消耗1molO2,需要12gC,而消耗1molO2,需要4gH,可知等质量时,烃中氢元素质量分数越大,消耗的O2越多,
CH4、C2H6、C3H6、C3H8分子中C、H原子数目之比分别为1:4、1:3、1:2、3:8,故四个选项中CH4的含氢量最大,等质量时,计算消耗的氧气应最多,
故选A.
点评 本题考查有机物耗氧量的判断,难度不大,注意比较C、H原子消耗氧气的关系得出:等质量时,烃中氢元素质量分数越大,消耗的O2越多.

练习册系列答案
相关题目
8.下列实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 | |
| A | 常温下,将Al箔插入浓HNO3中,无明显现象 | 铝和浓硝酸不反应 |
| B | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| C | 用铂丝蘸取溶液进行焰色反应,观察到火焰呈黄色 | 该溶液一定是钠盐溶液 |
| D | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| A. | A | B. | B | C. | C | D. | D |
6.如图所示,甲、乙两装置中除了铁片与铜片是否用导线连接外,其余均完全相同.若实验同时开始进行,当反应相同的时间时(反应均未停止),忽略电解质溶液的体积变化,则两装置中仍相同的是( )

| A. | 铁片的质量 | B. | 铜片的质量 | ||
| C. | 生成氢气的体积(同温同压) | D. | H+的物质的量浓度 |
13.有机物 又名萘,则萘的化学式为( )
又名萘,则萘的化学式为( )
 又名萘,则萘的化学式为( )
又名萘,则萘的化学式为( )| A. | C10H10 | B. | C10H8 | C. | C12H10 | D. | C10H12 |
10.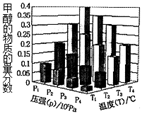 反应3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,下列判断正确的是( )
反应3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,下列判断正确的是( )
 反应3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,下列判断正确的是( )
反应3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,下列判断正确的是( )| A. | P3>P2 T3>T2 | B. | P2>P4 T4>T2 | C. | P1>P3 T1>T3 | D. | P1>P4 T2<T3 |
15.某未知溶液(只含一种溶质)中加入醋酸钠固体后,测得溶液中c(CH3COO-):c(Na+)=1:1.则原未知溶液一定不是( )
| A. | 强酸溶液 | B. | 弱酸性溶液 | C. | 弱碱性溶液 | D. | 强碱溶液 |
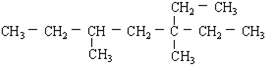 的名称3,5-二甲基-3-乙基庚烷
的名称3,5-二甲基-3-乙基庚烷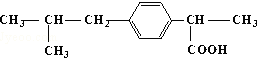 所含官能团的名称羧基
所含官能团的名称羧基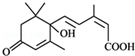 所含官能团的名称碳碳双键、羟基、羰基、羧基.
所含官能团的名称碳碳双键、羟基、羰基、羧基.