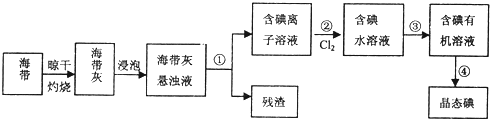
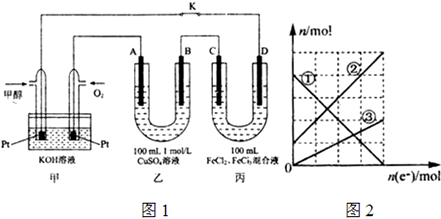
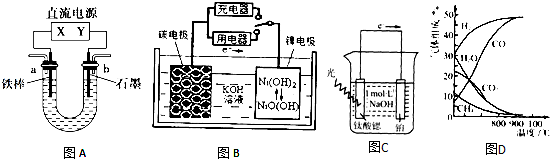
题目内容
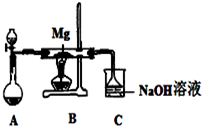 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.(1)选择制取SO2的合适试剂
①浓HCl ②浓H2SO4③Na2SO3固体 ④CaSO3固体
(2)上述装置还可改进,改进的方法是
(3)甲同学推测Mg与SO2的反应与CO2相似,则该反应方程式为
乙同学的推测是:2Mg+3SO2
| ||
| ||
要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/LNaOH、品红溶液、澄清石灰水、2mol/LCuSO4;仪器和用品自选.请填写下表中的空格:
根据上述实验探究:
| 序号 | 实验步骤 | 预期现象和结论 |
| ① | 取少量反应后的固体于试管I中 | / |
② | 向试管I中的固体慢慢滴加 试管I口塞上带导管的单孔塞,并将导管通入盛有 | 若试管I中的 则丙同学推测正确.若试管I中的固体未完全溶解,且 |
考点:性质实验方案的设计
专题:实验设计题
分析:(1)根据实验室制备SO2的原理,强酸制弱酸,据此进行判断需要的试剂;
(2)硫酸和亚硫酸钠反应生成硫酸钠、二氧化硫和水,所以在二氧化硫气体中含有水蒸气,水蒸气影响镁的化学反应,所以应在A、B之间加一个干燥管;计算出反应物的量,根据反应物过量情况判断反应产物,写出反应的离子方程式;
(3)根据Mg与CO2的反应知:Mg与SO2反应能生成氧化镁与单质硫;可根据反应产物的性质进行验证甲、乙、丙三位同学的推测是否正确.
(2)硫酸和亚硫酸钠反应生成硫酸钠、二氧化硫和水,所以在二氧化硫气体中含有水蒸气,水蒸气影响镁的化学反应,所以应在A、B之间加一个干燥管;计算出反应物的量,根据反应物过量情况判断反应产物,写出反应的离子方程式;
(3)根据Mg与CO2的反应知:Mg与SO2反应能生成氧化镁与单质硫;可根据反应产物的性质进行验证甲、乙、丙三位同学的推测是否正确.
解答:
解:(1)因SO2的溶解度较大,应选用浓度较大的H2SO4溶液;为了使反应顺利进行须选择Na2SO3固体与硫酸反应(CaSO3固体与硫酸反应生成的硫酸钙微溶于水),
故答案为:②③;
(2)硫酸和亚硫酸钠反应生成硫酸钠、二氧化硫和水,所以在二氧化硫气体中含有水蒸气,水蒸气影响镁的化学反应,所以应在A、B之间加一个干燥管;标况下1.12L二氧化硫的物质的量为:
=0.05mol,0.2mol/L、200mL氢氧化钠溶液中含有氢氧化钠的物质的量为:0.2mol/L×0.2L=0.04mol,0.04mol氢氧化钠最多消耗0.04mol二氧化硫,所以二氧化硫过量,二者反应生成亚硫酸氢钠,反应的离子方程式为:OH-+SO2=HSO3-,
故答案为:在A和B之间增加用浓硫酸干燥的装置;OH-+SO2=HSO3-;
(3)根据Mg与CO2的反应知:Mg与SO2反应能生成氧化镁与单质硫,反应方程式为:2Mg+SO2
2MgO+S,欲验证甲、乙、丙三位同学的推测是否正确,可根据反应产物的性质进行检验,MgSO3、MgO、MgS均溶于盐酸,硫不溶于盐酸;MgSO3与盐酸反应生成二氧化硫能使品红溶液褪色;若甲同学推测正确,加过量2mol/L盐酸MgO溶于盐酸但不生成二氧化硫,硫不溶于盐酸,现象为固体未完全溶解且品红溶液不褪色;若乙同学的推测是正确的,加过量2mol/L盐酸后MgSO3溶于盐酸且生成二氧化硫,硫不溶于盐酸,现象为固体未完全溶解且品红溶液褪色;若丙同学的推测是正确的,加过量2mol/L盐酸MgO、MgS溶于盐酸但不生成二氧化硫,现象为固体完全溶解且品红溶液不褪色,
故答案为:2Mg+SO2
2MgO+S;
.
故答案为:②③;
(2)硫酸和亚硫酸钠反应生成硫酸钠、二氧化硫和水,所以在二氧化硫气体中含有水蒸气,水蒸气影响镁的化学反应,所以应在A、B之间加一个干燥管;标况下1.12L二氧化硫的物质的量为:
| 1.12L |
| 22.4L/mol |
故答案为:在A和B之间增加用浓硫酸干燥的装置;OH-+SO2=HSO3-;
(3)根据Mg与CO2的反应知:Mg与SO2反应能生成氧化镁与单质硫,反应方程式为:2Mg+SO2
| ||
故答案为:2Mg+SO2
| ||
| ② | 2mol/L 盐酸至过量 品红溶液 | 固体完全溶解 品红溶液褪色 |
点评:本题以题干信息为载体,考查了物质性质实验方案的设计方法,题目难度中等,正确理解题干信息为解答关键,注意掌握物质性质实验方案设计的原则,试题侧重考查学生的知识迁移能力,有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 (1)某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.
(1)某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.