题目内容
如图1是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.
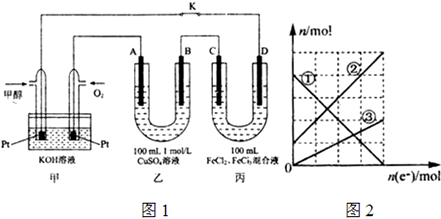
Ⅰ.工作一段时间后,断开K,此时C电极质量减少3.2g.
(1)甲中负极的电极反应式为
(2)乙溶液此时离子浓度由大到小的顺序是
Ⅱ.连接K,继续电解一段时间,当A,B两极上产生的气体体积相同时
(3)乙中A极析出的气体在标准状况下的体积为 ,溶质的物质的量浓度为 mol/L
(不考虑溶液体积变化)
(4)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2,则图2中②线表示的是 离子的变化;此时要使丙装置中金属阳离子恰好完全沉淀,需要 mL 5.0moL/L NaOH溶液.

Ⅰ.工作一段时间后,断开K,此时C电极质量减少3.2g.
(1)甲中负极的电极反应式为
(2)乙溶液此时离子浓度由大到小的顺序是
Ⅱ.连接K,继续电解一段时间,当A,B两极上产生的气体体积相同时
(3)乙中A极析出的气体在标准状况下的体积为
(不考虑溶液体积变化)
(4)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2,则图2中②线表示的是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:Ⅰ(1)甲醇燃料电池是原电池反应,甲醇在负极失电子发生氧化反应,注意电解质溶液是碱性溶液;
(2)利用电子守恒,计算3.2g铜反应转移电子物质的量,再据100mL1mol/L的硫酸铜溶液中含有溶质的物质的量和电解后生成硫酸的物质的量计算离子浓度;
Ⅱ(3)A为阳极,始终是氢氧根离子放电,B为阴极,开始是铜离子放电,后来是氢离子放电,据电子守恒计算产生气体体积;据硫酸根离子守恒计算所得硫酸溶液的物质的量浓度;
(4)C电极为阳极,D电极为阴极,根据丙图可知溶液中有三种金属阳离子,而根据丙的成分可知溶液中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此C电极是Cu做阳极,D电极是石墨做阴极,根据转移电子的物质的量和金属阳离子的物质的量的变化确定曲线对应的离子,结合转移电子的物质的量计算.
(2)利用电子守恒,计算3.2g铜反应转移电子物质的量,再据100mL1mol/L的硫酸铜溶液中含有溶质的物质的量和电解后生成硫酸的物质的量计算离子浓度;
Ⅱ(3)A为阳极,始终是氢氧根离子放电,B为阴极,开始是铜离子放电,后来是氢离子放电,据电子守恒计算产生气体体积;据硫酸根离子守恒计算所得硫酸溶液的物质的量浓度;
(4)C电极为阳极,D电极为阴极,根据丙图可知溶液中有三种金属阳离子,而根据丙的成分可知溶液中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此C电极是Cu做阳极,D电极是石墨做阴极,根据转移电子的物质的量和金属阳离子的物质的量的变化确定曲线对应的离子,结合转移电子的物质的量计算.
解答:
解:Ⅰ(1)甲醇燃料电池是原电池反应,甲醇在负极失电子发生氧化反应,电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(2)100mL1mol/L的硫酸铜溶液中含有铜离子0.1mo,硫酸根离子0.1mol,当电解硫酸铜溶液时,阴极反应式为:Cu2++2e-=Cu,阳极反应式为:4OH--4e-=2H2O+O2↑,C极有3.2gCu即0.05mol溶解,转移电子0.1mol,A极反应掉氢氧根离子0.1mol,生成氢离子0.1mol,B极反应掉铜离子0.05mol,剩余铜离子0.05mol,硫酸根离子物质的量没有变化,溶液中还存在水的电离平衡,所以离子浓度大小顺序为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-),
故答案为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-);
Ⅱ(3)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气,设生成气体物质的量为X,溶液中铜离子物质的量为0.1mol,电极反应为:
Cu2++2e-=Cu,2H++2e-=H2↑;
0.1mol 0.2mol 2x x
A电极为阳极,溶液中的氢氧根离子失电子生成氧气,电极反应为:
4OH--4e-=2H2O+O2↑;
4x x
得到0.2+2x=4x
x=0.1mol
乙中A极析出的气体是氧气物质的量为0.1mol,在标准状况下的体积为2.24L;
反应后所得溶液为硫酸溶液,硫酸根离子物质的量不变,若不考虑溶液体积变化,所得硫酸溶液的物质的量浓度仍为1mol/L;
故答案为:2.24L;1;
(4)根据转移电子的物质的量和金属阳离子的物质的量的变化,可知,铜离子从无增多,铁离子物质的量减小,亚铁离子增加,①为Fe3+,②为Fe2+,③为Cu2+,
依据(3)计算得到电子转移为0.2mol,当电子转移为0.2mol时,丙中阳极电极反应Cu-2e-=Cu2+,生成Cu2+物质的量为0.1mol,图象分析每个单位为0.05mol,阴极电极反应Fe3++e-=Fe2+,溶液中有Fe3+ 0.2mol,Fe2+ 0.3mol,Cu2+为0.1mol,所以需要加入NaOH溶液1.4mol,所以NaOH溶液等体积为1.4mol5mol/L=0.28L=280ml,
故答案为:Fe2+;280.
(2)100mL1mol/L的硫酸铜溶液中含有铜离子0.1mo,硫酸根离子0.1mol,当电解硫酸铜溶液时,阴极反应式为:Cu2++2e-=Cu,阳极反应式为:4OH--4e-=2H2O+O2↑,C极有3.2gCu即0.05mol溶解,转移电子0.1mol,A极反应掉氢氧根离子0.1mol,生成氢离子0.1mol,B极反应掉铜离子0.05mol,剩余铜离子0.05mol,硫酸根离子物质的量没有变化,溶液中还存在水的电离平衡,所以离子浓度大小顺序为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-),
故答案为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-);
Ⅱ(3)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气,设生成气体物质的量为X,溶液中铜离子物质的量为0.1mol,电极反应为:
Cu2++2e-=Cu,2H++2e-=H2↑;
0.1mol 0.2mol 2x x
A电极为阳极,溶液中的氢氧根离子失电子生成氧气,电极反应为:
4OH--4e-=2H2O+O2↑;
4x x
得到0.2+2x=4x
x=0.1mol
乙中A极析出的气体是氧气物质的量为0.1mol,在标准状况下的体积为2.24L;
反应后所得溶液为硫酸溶液,硫酸根离子物质的量不变,若不考虑溶液体积变化,所得硫酸溶液的物质的量浓度仍为1mol/L;
故答案为:2.24L;1;
(4)根据转移电子的物质的量和金属阳离子的物质的量的变化,可知,铜离子从无增多,铁离子物质的量减小,亚铁离子增加,①为Fe3+,②为Fe2+,③为Cu2+,
依据(3)计算得到电子转移为0.2mol,当电子转移为0.2mol时,丙中阳极电极反应Cu-2e-=Cu2+,生成Cu2+物质的量为0.1mol,图象分析每个单位为0.05mol,阴极电极反应Fe3++e-=Fe2+,溶液中有Fe3+ 0.2mol,Fe2+ 0.3mol,Cu2+为0.1mol,所以需要加入NaOH溶液1.4mol,所以NaOH溶液等体积为1.4mol5mol/L=0.28L=280ml,
故答案为:Fe2+;280.
点评:本题综合性较大,涉及燃料电池、离子浓度大小比较、电极反应式书写以及据电极反应式的计算,为高考常见题型,难度较大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列物质的分类结果全部正确的是( )
| A | B | C | D |
| 淀粉--混合物 | 液氯--非电解质 | 苯酚--有机物 | 水晶--分子晶体 |
| 胆矾--纯净物 | 碳酸钙--强电解质 | 纯碱--盐 | 食盐--离子晶体 |
| 盐酸--化合物 | 醋酸--弱电解质 | 水--氧化物 | 金刚石--原子晶体 |
| A、A | B、B | C、C | D、D |
下列实验装置或操作正确的是( )
A、 加热试管中的液体 |
B、 移走蒸发皿 |
C、 加热结晶水合物 |
D、 排水集气法收集NO |
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42一)加入足量NaOH,产生蓝色沉淀,过滤、洗涤、灼烧,得到CuO 12g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
| A、12.2 L |
| B、14.5 L |
| C、15.8 L |
| D、16.4 L |
下列离子方程式正确的是( )
| A、醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O |
| B、铁与盐酸反应:2Fe+6H+→2Fe3++3H2↑ |
| C、氯化铁溶液和氨水反应:Fe3++3OH-→Fe(OH)3↓ |
| D、氯化铝溶液中滴入过量氢氧化钠溶液:Al3++3OH-→Al(OH)3↓ |
 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.