题目内容
 (1)某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.
(1)某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.①滴定管如右图所示,用
②用滴定的方法来测定盐酸的浓度,实验数据如下所示:
| 实验编号 | 待测HCl溶液的体积(mL) | 滴入NaOH溶液的体积(mL) |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
③下列操作会使所测得的盐酸的浓度偏低的是
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数
(2)某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO3 2.38g的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应生成沉淀的离子),Cl-即被全部沉淀.然后用含Fe3+的溶液作指示剂,用0.2mol?L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度.
请回答下列问题:
①判断滴定达到终点的现象是
②考虑Ag+和Fe3+在酸或碱性溶液中的存在形式,在实施滴定的溶液以呈
③在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Cl-)的测定结果
考点:中和滴定
专题:实验题
分析:(1)①根据溶液的酸碱性选择滴定管;
②根据中和滴定原理计算盐酸的浓度;
③根据c(待测)=
分析不当操作对V(标准)×的影响,以此判断浓度的误差;
(2)①反应过程中用含Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3,滴入最后一滴后溶液变化为血红色证明反应达到终点;
②指示剂铁离子水解显酸性pH=3-4易形成沉淀不能指示反应终点,所以需在酸性溶液中滴定,NH4SCN标准溶液显酸性,可以加硝酸,但不能加盐酸,依据实验方案分析可知加入硝酸为最合适;
③因为硝酸银的总量一定,若两种沉淀表面吸附部分Ag+,导致测得过量的Ag+偏少,则与Cl-反应的Ag+的量会偏高.
②根据中和滴定原理计算盐酸的浓度;
③根据c(待测)=
| c(标准)V(标准) |
| V(待测) |
(2)①反应过程中用含Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3,滴入最后一滴后溶液变化为血红色证明反应达到终点;
②指示剂铁离子水解显酸性pH=3-4易形成沉淀不能指示反应终点,所以需在酸性溶液中滴定,NH4SCN标准溶液显酸性,可以加硝酸,但不能加盐酸,依据实验方案分析可知加入硝酸为最合适;
③因为硝酸银的总量一定,若两种沉淀表面吸附部分Ag+,导致测得过量的Ag+偏少,则与Cl-反应的Ag+的量会偏高.
解答:
解:(1)①NaOH溶液显碱性,故应用碱式滴定管盛装标准浓度的氢氧化钠溶液,故答案为:乙;
②根据表格,平均消耗V(NaOH)=
mL=23.00mL,
HCl+NaOH=NaCl+H2O
c(HCl)×20.00mL 0.80mol/L×23.00mL
c(HCl)=
=0.92mol?L-1;
故答案为:0.92mol?L-1;
③A.盛装待测液的锥形瓶用水洗后未干燥,不会产生误差;故A不符合;
B.碱式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
可知,测定c(HCl)偏大,故C不符合;
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗,测定V(HCl)偏大,根据c(待测)=
可知,测定c(HCl)偏大,故B不符合;
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数,造成V(标准)偏小,根据c(待测)=
可知,测定c(HCl)偏低,故D符合;
故答案为:D;
(2)①反应过程中用含Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3,滴入最后一滴后,溶液由无色变为血红色,且半分钟内不变色为血红色证明反应达到终点,
故答案为:溶液由无色变为血红色,且半分钟内不变色;
②指示剂铁离子水解显酸性PH=3-4易形成沉淀不能指示反应终点,所以需在酸性溶液中滴定,NH4SCN标准溶液显酸性;
故答案为:酸性;
③在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,因为硝酸银的总量一定,若两种沉淀表面吸附部分Ag+,导致测得过量的Ag+偏少,则与Cl-反应的Ag+的量会偏高,
故答案为:偏高.
②根据表格,平均消耗V(NaOH)=
| 23.00+23.10+22.90 |
| 3 |
HCl+NaOH=NaCl+H2O
c(HCl)×20.00mL 0.80mol/L×23.00mL
c(HCl)=
| 0.80mol/L×23.00mL |
| 20.00mL |
故答案为:0.92mol?L-1;
③A.盛装待测液的锥形瓶用水洗后未干燥,不会产生误差;故A不符合;
B.碱式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
| c(标准)V(标准) |
| V(待测) |
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗,测定V(HCl)偏大,根据c(待测)=
| c(标准)V(标准) |
| V(待测) |
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数,造成V(标准)偏小,根据c(待测)=
| c(标准)V(标准) |
| V(待测) |
故答案为:D;
(2)①反应过程中用含Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3,滴入最后一滴后,溶液由无色变为血红色,且半分钟内不变色为血红色证明反应达到终点,
故答案为:溶液由无色变为血红色,且半分钟内不变色;
②指示剂铁离子水解显酸性PH=3-4易形成沉淀不能指示反应终点,所以需在酸性溶液中滴定,NH4SCN标准溶液显酸性;
故答案为:酸性;
③在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,因为硝酸银的总量一定,若两种沉淀表面吸附部分Ag+,导致测得过量的Ag+偏少,则与Cl-反应的Ag+的量会偏高,
故答案为:偏高.
点评:本题主要考查了中和滴定操作、误差分析以及计算,物质组成的实验设计方案,滴定实验的数据计算应用,注意沉淀溶解平衡的分析判断,掌握基础是解题关键,题目难度中等,理解中和滴定的原理是解题关键.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
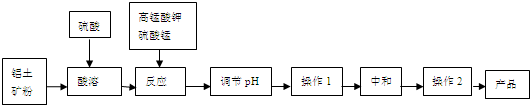
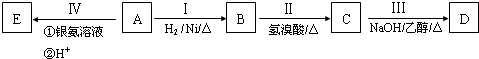
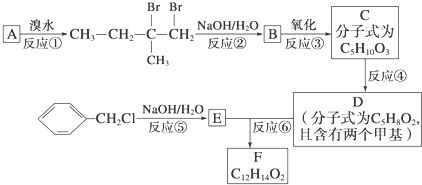
 ,由单体F制有机玻璃的反应类型是
,由单体F制有机玻璃的反应类型是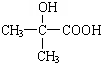 ,写出由G作为单体在一定条件下生成聚酯的化学方程式:
,写出由G作为单体在一定条件下生成聚酯的化学方程式: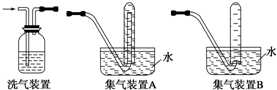
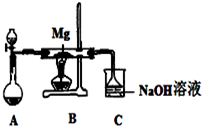 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.