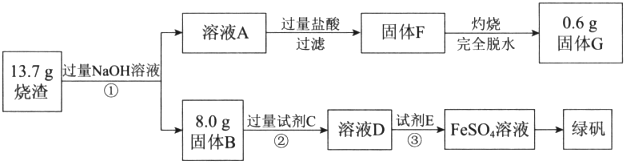
题目内容
6.高温下,粗硅与纯净的氯气反应,生成四氯化硅(SiCl4),再用氢气还原四氯化硅得到高纯硅.某实验小组在实验室制备并收集四氯化硅,装置示意图如下: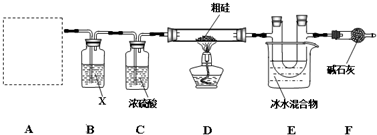
【查阅资料】四氯化硅极易与水反应,其熔点为-70.0℃,沸点为57.7℃.
回答下列问题:
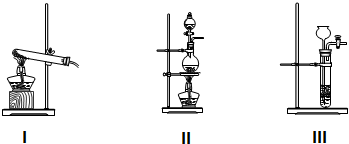
(1)①装置A用于制备氯气,应选用下列哪个装置Ⅱ(填序号).
②装置A中反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)装置B中X试剂是(填名称),装置C的作用是除去Cl2中混有的水蒸气.
(3)装置E中冰水混合物的作用是使四氯化硅冷凝.
(4)有同学认为装有碱石灰的干燥管可用装有NaOH溶液的烧杯代替,你认为不合理(填“合理”或“不合理”),理由是因为NaOH溶液只能吸收Cl2,而溶液的水蒸气会进入装置E中.
(5)某同学为了测定四氯化硅的纯度,取所得四氯化硅样品m g,用氢气在高温下还原,得到高纯硅 n g,则样品中四氯化硅的纯度是$\frac{85n}{14m}$×100%.
分析 高温下,粗硅与纯净的氯气反应,生成四氯化硅(SiCl4),再用氢气还原四氯化硅得到高纯硅,四氯化硅极易与水反应,装置A中是氯气的发生装置,生成的氯气通过装置B中X为饱和食盐水除去氯化氢气体,通过装置C中的浓硫酸除去水蒸气,得到干燥纯净的氯气进入中和粗硅反应生成四氯化硅,进入装置E冰水冷却得到纯净的四氯化硅,四氯化硅极易与水反应,装置F是防止空气中的水蒸气进入装置E中,
(1)①实验室是利用浓盐酸和二氧化锰加热反应生成气体,属于固体+液体$\frac{\underline{\;\;△\;\;}}{\;}$气体,选择氯气制备的发生装置;
②A中反应是浓盐酸和二氧化锰加热反应生成氯化锰、氯气和水,据此书写离子方程式;
(2)氯气中含氯化氢和水蒸气,氯化氢用饱和食盐水除去,水蒸气用浓硫酸除去;
(3)四氯化硅熔点为-70.0℃,冰水冷却使四氯化硅冷凝;
(4)四氯化硅极易与水反应,溶液中水蒸气会进入装置E;
(5)计算硅的物质的量得到四氯化硅物质的量,计算质量得到粗硅纯度;
解答 解:高温下,粗硅与纯净的氯气反应,生成四氯化硅(SiCl4),再用氢气还原四氯化硅得到高纯硅,四氯化硅极易与水反应,装置A中是氯气的发生装置,生成的氯气通过装置B中X为饱和食盐水除去氯化氢气体,通过装置C中的浓硫酸除去水蒸气,得到干燥纯净的氯气进入中和粗硅反应生成四氯化硅,进入装置E冰水冷却得到纯净的四氯化硅,四氯化硅极易与水反应,装置F是防止空气中的水蒸气进入装置E中,
(1)①实验室是利用浓盐酸和二氧化锰加热反应生成气体,属于固体+液体$\frac{\underline{\;\;△\;\;}}{\;}$气体,装置A用于制备氯气,应选用下列装置Ⅱ,故答案为:Ⅱ;
②A中反应是浓盐酸和二氧化锰加热反应生成氯化锰、氯气和水,据此书写离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)氯气中含氯化氢和水蒸气,氯化氢用饱和食盐水除去,水蒸气用浓硫酸除去,装置B中X试剂是(填名称)饱和食盐水,装置C的作用是;除去Cl2中混有的水蒸气,
故答案为:饱和氯化钠溶液;除去Cl2中混有的水蒸气;
(3)四氯化硅熔点为-70.0℃,装置E中冰水混合物的作用是使四氯化硅冷凝,
故答案为:使四氯化硅冷凝;
(4)四氯化硅极易与水反应,溶液中水蒸气会进入装置E会和四氯化硅发生反应不能得到纯净四氯化硅,因为NaOH溶液只能吸收Cl2,而溶液的水蒸气会进入装置E中,
故答案为:不合理;因为NaOH溶液只能吸收Cl2,而溶液的水蒸气会进入装置E中;
(5)取所得四氯化硅样品m g,用氢气在高温下还原,得到高纯硅 n g,硅物质的量n(Si)=$\frac{ng}{28g/mol}$=$\frac{n}{28}$mol,
硅元素守恒得到则样品中四氯化硅的纯度=$\frac{\frac{n}{28}mol×170g/mol}{mg}$×100%=$\frac{85n}{14m}$×100%
故答案为:$\frac{85n}{14m}$×100%.
点评 本题考查了物质组成的实验探究和性质分析判断,物质的检验方法和反应现象是解题关键,掌握基础是关键,题目难度中等.

| A. | a=b | B. | a<b<2a | C. | 2a=b | D. | 2a<b |
①平均摩尔质量 ②质量 ③颜色 ④压强 ⑤各组分的质量分数⑥密度.
| A. | ②⑥ | B. | ②③ | C. | ④⑤ | D. | ①⑥ |
①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1;
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列结论正确的是( )
| A. | .碳的燃烧热△H=-110.5 kJ•mol-1 | |
| B. | .①的反应热为221 kJ•mol-1 | |
| C. | 浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量为57.3 kJ | |
| D. | .碳的燃烧热大于110.5 kJ•mol-1 |
| A. | 该反应是一个放热反应 | |
| B. | 参加反应的氢气和氧气的总能量高于反应生成的水的总能量 | |
| C. | 在该化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量 | |
| D. | 发生反应时,断开反应物中的H-H键和O-O键都要吸收能量 |
 (1)良好的生态环境可以提升生活质量.
(1)良好的生态环境可以提升生活质量.