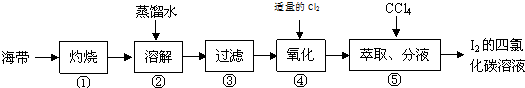
题目内容
11.为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):称取粗盐$→_{①}^{溶解}$$→_{②}^{BaCl_{2}}$$→_{③}^{NaOH}$$→_{④}^{NaCO_{3}}$$→_{⑤}^{过滤}$滤液$→_{⑥}^{适量盐酸}$$→_{⑦}^{蒸发、结晶、烘干}$精盐
1.判断BaCl2已过量的方法是用试管取少量第②步操作后的上层清液,再滴入几滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量.
2.第④步中,相关的离子方程式是Ca2++CO32-═CaCO3↓,Ba2++CO32-═BaCO3↓
3.实验室需要500ml 0.2mol/L的NaCl溶液,有如下操作:
①把称好的NaCl放入小烧杯中,加适量蒸馏水溶解.
②根据计算用托盘天平称取NaCl5.9克.
③把①所得溶液小心转入一定容积的容量瓶中.
④继续向容量瓶中加蒸馏水至液面距刻度线1cm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切.
⑤用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀.
⑥将容量瓶瓶塞塞紧,充分摇匀.
请填写下列空白:
(1)上述步骤中要称量的NaCl固体为5.9克
(2)操作步骤的正确顺序为(填序号)②①③⑤④⑥.
(3)实验室有如下规格的容量瓶:①100mL ②250mL ③500mL ④1000mL,本实验选用③(填序号).
(4)本实验用到的基本实验仪器除托盘天平,药匙以外还有:烧杯、玻璃棒、胶头滴管和500ml容量瓶.
4.配制NaCl溶液时,若出现下列操作,其结果偏高还是偏低?(填“偏高”、“偏低”或“无影响”)
①称量NaOH固体时,物码倒置(1克以下用游码)偏低
②没有进行操作步骤⑤偏低 ③容量瓶中原来有少量水无影响
④某同学定容时俯视容量瓶刻度线偏高
⑤定容,摇匀后发现液面低于刻度线,拿胶头滴管又加入蒸馏水使液体凹液面再次与刻度线相切偏低.
分析 由流程可知,②中加氯化钡可除去硫酸根离子,③中加NaOH除去镁离子和三价铁离子,④中加碳酸钠可除去钡离子、钙离子,过滤后主要为氯化钠和碳酸钠,⑥中加盐酸反应后溶液中溶质为NaCl,然后蒸发结晶得到NaCl,以此来解答.
1.根据BaCl2已过量,说明溶液中没有硫酸根离子,则再加氯化钡不会生成沉淀分析;
2.第④步中加入过量的碳酸钠不仅除去钙离子而且还除去了过量的钡离子,据此书写相关的离子方程式;
3.(1)根据m=nM=cVM计算结合天平的精确度分析;
(2)配制时,一般可分为以下几个步骤:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀,据此进行排序;
(3)选用容量瓶的规格要等于或稍大于配制溶液的体积;
(4)根据仪器的作用选取仪器;
4.根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断,如果n偏大或V偏小,则所配制溶液浓度偏高,如果n偏小或V偏大,则所配制溶液的浓度偏低.
解答 解:1.BaCl2已过量,说明溶液中没有硫酸根离子,则再加氯化钡不会生成沉淀,则实验方法为用试管取少量第②步操作后的上层清液,再滴入几滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:用试管取少量第②步操作后的上层清液,再滴入几滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
2.④中加碳酸钠可除去钡离子、钙离子,发生离子反应为Ca2++CO32-═CaCO3↓、Ba2++CO32-═BaCO3↓,故答案为:Ca2++CO32-═CaCO3↓;Ba2++CO32-═BaCO3↓;
3.(1)根据m=nM=cVM=0.500L×0.2mol/L×58.5g/mol=5.85g,又天平只能称到0.1g,所以要称量的NaCl固体为5.9g,故答案为:5.9;
(2)配制时,一般可分为以下几个步骤:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀,所以其操作步骤的正确顺序为②①③⑤④⑥,故答案为:②①③⑤④⑥;
(3)实验500ml 0.2mol/L的NaCl溶液,所以选取500mL容量瓶,故选:③;
(4)需要用天平、药匙称量药品,用烧杯、玻璃棒溶解药品,用胶头滴管定容,还有500ml容量瓶,所以除托盘天平,药匙以外还有烧杯、玻璃棒、胶头滴管和500ml容量瓶,故答案为:烧杯、玻璃棒、胶头滴管和500ml容量瓶;
4.①称量NaCl时,物码倒置(1g以下用游码),导致溶质的物质的量偏小,所以配制溶液的浓度偏低,故答案为:偏低;
②没有进行操作步骤⑤即没有洗涤玻璃棒和烧杯导致溶质的物质的量偏小,所以配制溶液的浓度偏低,故答案为:偏低;
③容量瓶原来有少量水,不影响溶质的物质的量和溶液的体积,所以对配制溶液的浓度无影响,故答案为:无影响;
④定容时俯视液面,导致溶液的体积偏小,则配制溶液的浓度偏高,故答案为:偏高;
⑤定容,摇匀后发现液面低于刻度线,拿胶头滴管又加入蒸馏水使液体凹液面再次与刻度线相切,导致溶液的体积偏大,则配制溶液的浓度偏低,故答案为:偏低.
点评 本题考查了粗盐提纯以及一定物质的量浓度溶液的配制、仪器的选择以及误差分析,注意把握粗盐提纯流程中的分离方法及发生的离子反应为解答的关键,侧重分析能力及物质除杂的考查,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 蛋白质、棉花、PVC、淀粉、涤纶都是由高分子组成的物质 | |
| B. | 乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者 | |
| C. | 雾霾天气的造成与PM2.5指数有着重要的关系,PM2.5是指大气中直径小于或等于2.5pm(皮米)的颗粒物 | |
| D. | 将废动植物油脂经反应改性制成“生物柴油”,代替柴油作为内燃机燃料的做法符合“绿色化学”的理念 |
Ⅰ.向铁硼矿粉中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量双氧水,再调节溶液的pH约为5;
Ⅲ.过滤,将所得滤液蒸发浓缩、冷却结晶、过滤得粗硼酸和含镁盐的母液;
Ⅳ.粗硼酸精制得硼酸.
已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 | |
| 开始沉淀时 | 3.8 | 5.8 | 2.2 | 10.6 |
| 完全沉淀时 | 4.7 | 8.3 | 4.0 | 12 |
请回答:
(1)写出Mg2B2O5•H2O与硫酸反应的化学方程式:Mg2B2O5•H2O+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2H3BO3+2MgSO4.
(2)为提高步骤I中的反应速率,可采取的措施有升高温度、适当增大硫酸的浓度或减小铁硼矿粉的粒径等(写出两条).
(3)步骤Ⅱ的目的是将Fe2+氧化为Fe3+;使Al3+与Fe3+形成氢氧化物沉淀而除去.
(4)“粗硼酸”中的主要杂质是MgSO4.
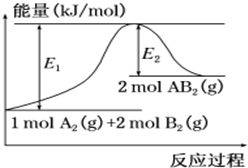 已知某化学反应A2 (g)+2B2 (g)═2AB2(g) (AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )
已知某化学反应A2 (g)+2B2 (g)═2AB2(g) (AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )| A. | 该反应的进行一定需要加热 | |
| B. | 该反应的△H=-(E1-E2)kJ/mol | |
| C. | 该反应中反应物的键能总和大于生成物的键能总和 | |
| D. | 断裂1 mol A-A和2 mol B-B放出E1 kJ能量 |
| A. | 对CO(g)+H2S(g)?COS(g)+H2(g)达到平衡后,升高温度,H2S浓度增加,表明该反应是吸热反应 | |
| B. | 对CO(g)+H2S(g)?COS(g)+H2(g)达到平衡后,通入CO后,正反应速率逐渐增大 | |
| C. | 一定条件下反应N2+3H2?2NH3达到平衡时,3v正(H2)=2v逆(NH3) | |
| D. | 对于反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,只改变压强,平衡不发生移动,反应放出的热量不变 |
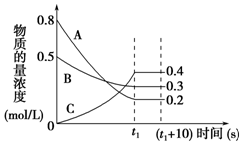
| A. | t1s时反应物A的转化率为60% | |
| B. | 在t1~(t1+10)s时,v(A)=v(B)=0 | |
| C. | 该反应的化学方程式为3A+B?2C | |
| D. | 0~t1s内A的反应速率为v(A)=$\frac{0.2}{{t}_{1}}$mol/(L•s) |