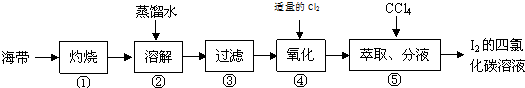
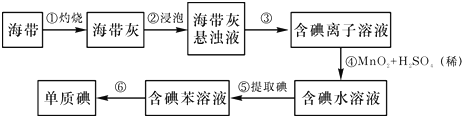
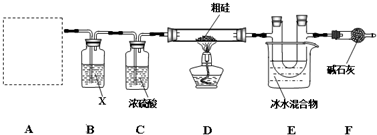
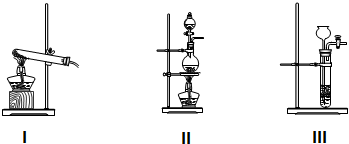
题目内容
16.氯化钠是日常生活的必需品,也是重要的化工原料.粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质.以下是粗盐提纯的操作流程.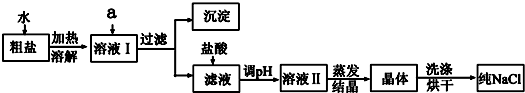
限选试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液.
(1)欲除去溶液Ⅰ中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、过量BaCl2溶液、过量Na2CO3溶液;生成的沉淀含有的成分为泥沙、Mg(OH)2、CaCO3、BaCO3、BaSO4.
(2)在滤液中加盐酸发生反应的离子方程式是CO32-+2H+=CO2↑+H2O、OH-+H+=H2O;
(3)对溶液Ⅱ处理得到晶体时,所必须使用到的玻璃仪器有2种.
(4)得到的NaCl纯品经测定发现其含有的NaCl与粗盐中NaCl的质量一致,某同学认为此次实验非常成功没有误差,你是否同意他的观点?否(填“是”或“否”),并给出你的理由加入Na2CO3后与HCl反应也得到了一定量的NaCl,故制得的纯品中NaCl的质量应比粗盐中NaCl的质量要大.
分析 欲除去溶液I中的MgCl2、CaCl2、Na2SO4,为了不增加新的杂质,根据酸、碱、盐的性质及复分解反应的条件可知,用NaOH除掉氯化镁,用BaCl2除掉硫酸钠,用Na2CO3除掉氯化钙与多余的BaCl2,最后将沉淀滤出,向混合液加入盐酸,除去剩余的氢氧根、碳酸根离子,最后得到氯化钠溶液,蒸发结晶得到氯化钠的固体物质.
(1)除去溶液I中的MgCl2、CaCl2、Na2SO4,则用氢氧化钠除掉氯化镁,用氯化钡除掉硫酸钠,用碳酸钠除掉氯化钙与多余的氯化钡;
(2)滤液中加盐酸的作用,应考虑除去NaOH、Na2CO3溶液;
(3)蒸发结晶得到晶体的操作是:蒸发、过滤,用到玻璃仪器:蒸发皿、玻璃棒;
(4)根据粗盐提纯时,加入Na2CO3后与HCl反应也得到了一定量的NaCl来分析判断.
解答 解:欲除去溶液I中的MgCl2、CaCl2、Na2SO4,为了不增加新的杂质,根据酸、碱、盐的性质及复分解反应的条件可知,用NaOH除掉氯化镁,用BaCl2除掉硫酸钠,用Na2CO3除掉氯化钙与多余的BaCl2,最后将沉淀滤出,向混合液加入盐酸,除去剩余的氢氧根、碳酸根离子,最后得到
氯化钠溶液,蒸发结晶得到氯化钠的固体物质.
(1)欲除去溶液I中的MgCl2、CaCl2、Na2SO4,为了不增加新的杂质,根据酸、碱、盐的性质及复分解反应的条件可知,用NaOH除掉氯化镁,用BaCl2除掉硫酸钠,用Na2CO3除掉氯化钙与多余的BaCl2,正确滴加顺序依次为:过量BaCl2溶液、过量Na2CO3溶液,产生的难溶物分别是Mg(OH)2、CaCO3、BaCO3、BaSO4.
故答案为:过量的BaCl2、过量的Na2CO3;Mg(OH)2、CaCO3、BaCO3、BaSO4;
(2)在滤液中加盐酸可以跟过量的NaOH和过量的Na2CO3反应,除去NaOH、Na2CO3溶液,反应为:CO32-+2H+=CO2↑+H2O、OH-+H+=H2O,故答案为:CO32-+2H+=CO2↑+H2O、OH-+H+=H2O;
(3)对溶液Ⅱ处理得到晶体时,需要蒸发结晶操作,所必须使用到的玻璃仪器有蒸发皿、玻璃棒2种,故答案为:2;
(4)加入Na2CO3后与HCl反应也得到了一定量的NaCl,故制得的纯品中NaCl的质量应比粗盐中NaCl的质量要大,故答案为:否;加入Na2CO3后与HCl反应也得到了一定量的NaCl,故制得的纯品中NaCl的质量应比粗盐中NaCl的质量要大.
点评 本题考查了物质的除杂和有关溶液的计算和配制,难度比较大,特别的除去食盐中的多种杂质,要根据除杂的原理深入思考,按照最优化的顺序添加除杂剂.

| A. | 维生素A | B. | 维生素B | C. | 维生素C | D. | 维生素K |
| 物质 | 大气中的含量 (体积百分比) | 温室效应 指数 |
| CO2 | 0.03 | 1 |
| H2O | 1 | 0.1 |
| CH4 | 2×10-4 | 30 |
| N2O4 | 3×10-5 | 160 |
| O3 | 4×10-6 | 2000 |
| CCl2F2 | 4.8×10-8 | 25000 |
(1)6种气体中,温室效应指数最大的物质属于极性分子(选填“极性分子”或“非极性分子”).
(2)1mol CO2中σ键的数目为2NA,由第二周期原子构成与CO2互为等电子体的分子是N2O,阴离子是N3-.(写一种)
(3)水的沸点高于CO2的原因是水分子间含氢键,冰熔化时体积变小密度变大的原因是晶体结构被破坏,使分子间隙减小.
(4)配合物Fe (CO)5结构式如图:
 配合物中碳原子的轨道杂化类型是sp杂化;1mol Fe (CO)5分子中含有σ键的数目为10NA.
配合物中碳原子的轨道杂化类型是sp杂化;1mol Fe (CO)5分子中含有σ键的数目为10NA.