题目内容
15.将一小块钠投入下列溶液中,既能产生气体又能出现白色沉淀的是( )| A. | 稀硫酸 | B. | 氢氧化钠溶液 | C. | 硫酸铜溶液 | D. | 氯化亚铁溶液 |
分析 根据钠的化学性质:与水、酸、盐溶液的反应,利用2Na+2H2O=2NaOH+H2↑及生成的碱与盐的反应来得出反应现象.
解答 解:A、因钠与稀硫酸反应,生成物为硫酸钠和氢气,有气体产生,故A错误;
B、因钠不能与氢氧化钠反应,但能与溶液中的水反应,生成物为氢氧化钠和氢气,2Na+2H2O=2NaOH+H2↑,有气体产生,故B错误;
C、因为钠的化学性质活泼,投入硫酸铜溶液中后,钠首先与水反应生成氢氧化钠和氢气,然后氢氧化钠与硫酸铜生成氢氧化铜蓝色的沉淀,故C错误;
D、因为钠的化学性质活泼,投入氯化亚铁溶液中后,钠首先与水反应生成氢氧化钠和氢气,然后氢氧化钠与氯化亚铁生成氢氧化亚铁白色的沉淀,故D正确;
故选D.
点评 本题比较简单,钠与碱、盐的反应中首先考虑与溶液中的水反应,然后再看生成的氢氧化钠能否与碱、盐本身反应.

练习册系列答案
相关题目
17.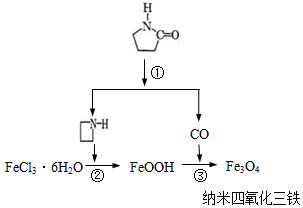 纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )
纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )
 纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )
纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )| A. | 在反应②中,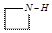 的作用可能是促进氯化铁水解 的作用可能是促进氯化铁水解 | |
| B. | 反应③的化学方程式是:6FeOOH+CO═2Fe3O4+3H2O+CO2 | |
| C. | 直接加热FeCl3溶液也可以得到四氧化三铁 | |
| D. | 纳米四氧化三铁形成的分散剂,有可能产生丁达尔现象 |
6.下列性质可以证明某化合物内一定存在离子键的是( )
| A. | 可溶于水 | B. | 熔融状态能导电 | C. | 水溶液能导电 | D. | 具有较高熔点 |
20.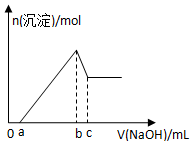 某无色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、Cl-、SO42-、NO3-中的几种,取该溶液三等份分别进行实验①加入少量Zn产生H2,②逐滴加入NaOH溶液,其加入量和沉淀生成量关系如图所示,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )
某无色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、Cl-、SO42-、NO3-中的几种,取该溶液三等份分别进行实验①加入少量Zn产生H2,②逐滴加入NaOH溶液,其加入量和沉淀生成量关系如图所示,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )
 某无色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、Cl-、SO42-、NO3-中的几种,取该溶液三等份分别进行实验①加入少量Zn产生H2,②逐滴加入NaOH溶液,其加入量和沉淀生成量关系如图所示,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )
某无色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、Cl-、SO42-、NO3-中的几种,取该溶液三等份分别进行实验①加入少量Zn产生H2,②逐滴加入NaOH溶液,其加入量和沉淀生成量关系如图所示,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )| A. | 一定没有NO3- | B. | 可能有K+、NO3-、SO42- | ||
| C. | 不能确定是否含有K+、NO3- | D. | 一定有Mg2+、Al3+、Cl-、SO42- |
4.在0℃、1.01×105Pa下,下列各组气体混合后,其平均分子量可能达到50的是( )
| A. | O2,F2 | B. | HF,Cl2 | C. | HI,HBr | D. | HI,Cl2 |
5.下列关于化学键的说法不正确的是( )
| A. | 化学键存在于分子之间 | |
| B. | 化学键存在于分子内部 | |
| C. | 化学键是一种作用力 | |
| D. | 化学键可以是原子间作用力,也可以是离子间作用力 |