题目内容
17.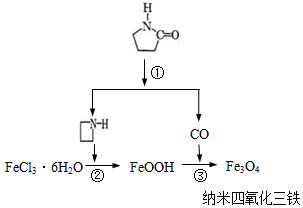 纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )
纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )| A. | 在反应②中,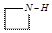 的作用可能是促进氯化铁水解 的作用可能是促进氯化铁水解 | |
| B. | 反应③的化学方程式是:6FeOOH+CO═2Fe3O4+3H2O+CO2 | |
| C. | 直接加热FeCl3溶液也可以得到四氧化三铁 | |
| D. | 纳米四氧化三铁形成的分散剂,有可能产生丁达尔现象 |
分析 A.根据反应②环丙胺没有参加反应来分析;
B.根据反应③中的反应物与生成物及质量守恒定律来分析;
C.加热氯化铁溶液,由于HCl易挥发,最终得到的为氧化铁,不是四氧化三铁;
D.纳米四氧化三铁形成的分散剂属于胶体,利用胶体的性质来分析.
解答 解:A.因反应②环丙胺不参加反应,但加快反应速率,即加快了氯化铁水解,故A正确;
B.由制备过程图可知,反应③的反应物为FeOOH和CO,由一种生成物为Fe3O4和质量守恒定律可知反应为:6FeOOH+CO═2Fe3O4+3H2O+CO2,故B正确;
C.直接加热FeCl3溶液,促进了氯化铁的水解,HCl易挥发,最终氢氧化铁分解生成氧化铁,不会得到四氧化三铁,故C错误;
D.纳米四氧化三铁分散在适当分散剂中,属于胶体分散系,则具有丁达尔现象,故D正确;
故选C.
点评 本题属于信息习题,为高考常见题型,侧重于学生的分析能力的考查,学生应注重习题信息和所学知识相结合来解答本题,并注意质量守恒定律、胶体的性质等来解答.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.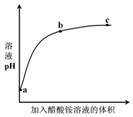 室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵
室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵
溶液体积变化的曲线示意图如图所示.下列分析正确的是( )
 室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵
室温下,向0.01mol•L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化的曲线示意图如图所示.下列分析正确的是( )
| A. | a点,pH=2 | |
| B. | b点,c(CH3COO-)>c(NH4+) | |
| C. | c点,pH可能大于7 | |
| D. | ac段,溶液pH增大是CH3COOH?H++CH3COO-逆向移动的结果 |
8.工业上曾经通过反应“3Fe+4NaOH=Fe3O4+2H2↑+4Na↑”生产金属钠.下列有关说法正确的是( )
| A. | 不能用磁铁将Fe与Fe3O4分离 | |
| B. | 将生成的气体在空气中冷却可获得钠 | |
| C. | 该反应条件下铁的氧化性比钠强 | |
| D. | 该反应中每生成2 mol H2,转移的电子数约为4×6.02×1023 |
12.下列各组物质中,X表示某物,Y表示X物质中含有的少量杂,Z表示要除去杂质加入的试剂,其中正确的组别是( )
| X | Y | Z | |
| A | FeCl2 溶液 | FeCl3 | KSCN 溶液 |
| B | H2 | SO2 | NaOH 溶液 |
| C | Fe2(SO4)3溶液 | FeSO4 | Cl2 |
| D | SiO2 | Fe2O3 | NaOH 溶液 |
| A. | A | B. | B | C. | C | D. | D |
2.下列工业制法和生产中,说法正确的是( )
| A. | 金属钠可以从四氯化钛溶液中置换出金属钛 | |
| B. | 工业制备和提纯硅的三步化学反应都是氧化还原反应 | |
| C. | 镁的提取中将氯化镁溶液蒸发结晶可直接获得无水氯化镁,电解熔融无水氯化镁得到金属镁 | |
| D. | 硫酸的工业制法中,依次使用的三种设备是沸腾炉,接触室,吸收塔 |
9.下列物质的水溶液因水解而呈酸性的是( )
| A. | NaHCO3 | B. | NaNO3 | C. | CaCl2 | D. | NH4Cl |
15.将一小块钠投入下列溶液中,既能产生气体又能出现白色沉淀的是( )
| A. | 稀硫酸 | B. | 氢氧化钠溶液 | C. | 硫酸铜溶液 | D. | 氯化亚铁溶液 |