题目内容
20.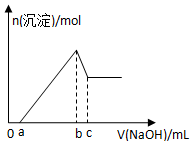 某无色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、Cl-、SO42-、NO3-中的几种,取该溶液三等份分别进行实验①加入少量Zn产生H2,②逐滴加入NaOH溶液,其加入量和沉淀生成量关系如图所示,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )
某无色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、Cl-、SO42-、NO3-中的几种,取该溶液三等份分别进行实验①加入少量Zn产生H2,②逐滴加入NaOH溶液,其加入量和沉淀生成量关系如图所示,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )| A. | 一定没有NO3- | B. | 可能有K+、NO3-、SO42- | ||
| C. | 不能确定是否含有K+、NO3- | D. | 一定有Mg2+、Al3+、Cl-、SO42- |
分析 某无色透明酸性溶液,一定不含Cu2+,②逐滴加入NaOH溶液,其加入量和沉淀生成量关系如图所示,开始没有沉淀生成,后沉淀先是增大,后接着减小,则一定含有H+、Mg2+、Al3+,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,一定含有SO42-,硫酸根离子和钡离子的物质的量是相等的,即为0.1mol/×0.005L=0.0005mol,氯化钡中氯离子的物质的量是0.001mol,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,则AgCl的物质的量是0.002mol,所以原溶液含有氯离子是0.001mol,①加入少量Zn产生H2,则溶液中不能含有NO3-,根据电荷守恒可以确定钾离子是否存在.
解答 解:某无色透明酸性溶液,一定不含Cu2+,②逐滴加入NaOH溶液,其加入量和沉淀生成量关系如图所示,开始没有沉淀生成,后沉淀先是增大,后接着减小,则一定含有H+、Mg2+、Al3+,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,一定含有SO42-,硫酸根离子和钡离子的物质的量是相等的,即为0.1mol/×0.005L=0.0005mol,氯化钡中氯离子的物质的量是0.001mol,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,则AgCl的物质的量是0.002mol,所以原溶液含有氯离子是0.001mol,①加入少量Zn产生H2,则溶液中不能含有NO3-,
综上知道:溶液中一定存在的离子有:Mg2+、Al3+、Cl-、SO42-,一定不存在的是Cu2+、NO3-.由于Mg2+、Al3+物质的量不确定,故K+离子无法判断,
故选AD.
点评 本题考查了常见阴阳离子的检验,题目难度中等,注意掌握常见的离子之间的反应现象及检验方法,能够根据反应现象判断溶液中存在的离子和不能存在的离子.

| A. | 金属钠可以从四氯化钛溶液中置换出金属钛 | |
| B. | 工业制备和提纯硅的三步化学反应都是氧化还原反应 | |
| C. | 镁的提取中将氯化镁溶液蒸发结晶可直接获得无水氯化镁,电解熔融无水氯化镁得到金属镁 | |
| D. | 硫酸的工业制法中,依次使用的三种设备是沸腾炉,接触室,吸收塔 |
| 实验现象 | 分析或结论 | |
| A | 光照新制氯水有气泡冒出 | 氯水含有Cl2,光照Cl2逸出 |
| B | 液氯滴到干燥的有色布条会褪色 | 液氯中的次氯酸具有漂白性 |
| C | 往NaHCO3固体加入新制氯水,有无色无味的气体产生 | 氯水中含有盐酸与NaHCO3反应,产生CO2 |
| D | 新制氯水放置数天后,pH值将增大 | 氯化氢具有挥发性,酸性减弱 |
| A. | A | B. | B | C. | C | D. | D |
 ,下列对脑白金主要成分的推论错误的是( )
,下列对脑白金主要成分的推论错误的是( )| A. | 其分子式为C13H16N2O | B. | 能发生水解反应生成乙酸 | ||
| C. | 能与溴水发生反应 | D. | 其官能团及营养成分与葡萄糖相同 |
| A. | 稀硫酸 | B. | 氢氧化钠溶液 | C. | 硫酸铜溶液 | D. | 氯化亚铁溶液 |
| A. | 未达恒重即停止实验 | B. | 加热时有晶体溅出 | ||
| C. | 黏在玻璃棒上固体刮入坩埚 | D. | 固体加热至淡蓝色即停止 |
| A. | Ca(ClO)2用于消毒杀菌 | B. | 用铝制容器盛装稀硫酸 | ||
| C. | Fe2O3用于炼铁 | D. | 氧化镁作耐火材料 |
| A. | CH≡CH | B. | CO2 | C. | NH4Cl | D. | CH4 |