题目内容
氧化还原反应是有元素化合价发生改变的化学反应,氧化还原反应的本质是 .在氧化还原反应中,还原剂 电子,本身发生 反应.Na2O2中氧元素化合价为-1价,根据氧化还原反应的知识可以推知Na2O2既有 性又有 性.Na2O2和KMnO4的H2SO4溶液反应,生成Na2SO4,MnSO4,K2SO4,O2和水,在这个反应中氧化剂为 ,还原剂为 .
考点:氧化还原反应
专题:氧化还原反应专题
分析:氧化还原反应的实质为电子转移,还原剂失去电子,被还原;处于中间价态的微粒,既能失去电子也能得到电子;Na2O2和KMnO4的H2SO4溶液反应为5Na2O2+2KMnO4+8H2SO4=5Na2SO4+2MnSO4+K2SO4+5O2↑+8H2O,Mn元素的化合价降低,过氧化钠中O元素的化合价升高,以此来解答.
解答:
解:氧化还原反应的实质为电子转移,还原剂失去电子,被还原,发生还原反应;Na2O2中氧元素化合价为-1价,既能失去电子也能得到电子,则既有氧化剂也有还原性;Na2O2和KMnO4的H2SO4溶液反应为5Na2O2+2KMnO4+8H2SO4=5Na2SO4+2MnSO4+K2SO4+5O2↑+8H2O,Mn元素的化合价降低,过氧化钠中O元素的化合价升高,所以氧化剂为KMnO4,还原剂为Na2O2,
故答案为:电子转移;失去;还原;氧化;还原;KMnO4;Na2O2.
故答案为:电子转移;失去;还原;氧化;还原;KMnO4;Na2O2.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意元素化合价与微粒性质的关系,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在HCN溶液中有如下平衡:HCN?H++CN-,向该溶液中加入少量的下列物质后,一定能使电离平衡向右移动的是( )
| A、NaOH溶液 |
| B、硫酸溶液 |
| C、NaCN溶液 |
| D、盐酸溶液 |
β-紫罗兰酮是存在于玫瑰花中的一种天然香料,它经多步反应可合成维生素A1.下列说法正确的是( )

| A、β-紫罗兰酮可使酸性KMnO4溶液褪色 |
| B、1mol中间体X最多能与2molH2发生加成反应 |
| C、维生素A1难溶于水 |
| D、β-紫罗兰酮与中间体X互为同分异构体 |
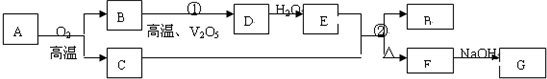

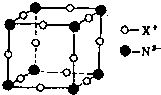 氮元素是重要的非金属元素,可形成卤化物、氮化物,叠氮化物及配合物等多种化合物.
氮元素是重要的非金属元素,可形成卤化物、氮化物,叠氮化物及配合物等多种化合物.