题目内容
经测定0.1mol/L的KHSO4溶液与0.1mol/L的HCl溶液中的氢离子浓度基本相同,则KHSO4的电离方程式可以表示为 ;
(1)往0.1mol/L的KHSO4溶液中加入锌片,预计可以观察到的现象是 ,反应的离子方程式为 .
(2)某同学向一定量的KHSO4溶液中滴加Ba(OH)2溶液至混合液呈中性,此时的变化可以用离子方程式表示为 ,继续滴加Ba(OH)2溶液,其变化可以用离子方程式表示为 .
(1)往0.1mol/L的KHSO4溶液中加入锌片,预计可以观察到的现象是
(2)某同学向一定量的KHSO4溶液中滴加Ba(OH)2溶液至混合液呈中性,此时的变化可以用离子方程式表示为
考点:电离方程式的书写,离子方程式的书写
专题:离子反应专题
分析:硫酸氢钾是强电解质,电离利用“═”,注意强酸的酸式酸根离子应电离出氢离子,并遵循电荷守恒、质量守恒定律;
(1)含有氢离子的酸性溶液和金属锌反应可以生成氢气,据此回答;
(2)溶液中氢离子物质的量等于氢氧根离子的物质的量,溶液显中性,硫酸根离子可以和钡离子之间反应生成沉淀.
(1)含有氢离子的酸性溶液和金属锌反应可以生成氢气,据此回答;
(2)溶液中氢离子物质的量等于氢氧根离子的物质的量,溶液显中性,硫酸根离子可以和钡离子之间反应生成沉淀.
解答:
解:KHSO4为强电解质,电离方程式为KHSO4═K++H++SO42-,故答案为:KHSO4═K++H++SO42-;
(1)硫酸氢钾溶液中含有氢离子,可以和金属锌反应生成氢气,实质是:Zn+2H+=Zn2++H2↑,故答案为:有无色气泡冒出;Zn+2H+=Zn2++H2↑;
(2)向一定量的KHSO4溶液中滴加Ba(OH)2溶液至混合液呈中性,此时氢氧化钡中的氢氧根离子完全消耗,氢离子物质的量等于氢氧根离子的物质的量,即Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,继续滴加滴加Ba(OH)2溶液,则Ba2++SO42-=BaSO4↓,
故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;Ba2++SO42-=BaSO4↓.
(1)硫酸氢钾溶液中含有氢离子,可以和金属锌反应生成氢气,实质是:Zn+2H+=Zn2++H2↑,故答案为:有无色气泡冒出;Zn+2H+=Zn2++H2↑;
(2)向一定量的KHSO4溶液中滴加Ba(OH)2溶液至混合液呈中性,此时氢氧化钡中的氢氧根离子完全消耗,氢离子物质的量等于氢氧根离子的物质的量,即Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,继续滴加滴加Ba(OH)2溶液,则Ba2++SO42-=BaSO4↓,
故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;Ba2++SO42-=BaSO4↓.
点评:本题考查学生溶液中离子之间的反应,注意硫酸氢钾是显示强酸性的盐类,难度不大.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
下列实验事实与平衡移动无关的是( )
| A、氯气难溶于饱和食盐水 |
| B、用加压的方法促进CO2在水中的溶解 |
| C、FeCl3+3KSCN?Fe(SCN)3+KCl,向体系中加入KCl固体 |
| D、合成氨工业中,及时将氨气液化移出 |
相同质量的下列气体中,所含原子数最多的是( )
| A、CH4 |
| B、CO |
| C、H2 |
| D、O2 |
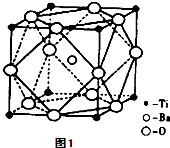
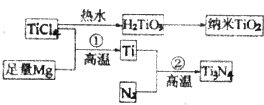
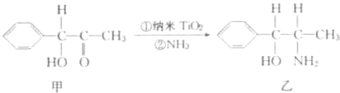
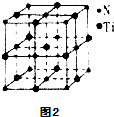
 能源、材料和信息是现代社会的三大“支柱”.
能源、材料和信息是现代社会的三大“支柱”.