题目内容
物质A~G有如图转化关系(部分反应物、生成物没有列出).其中A为某金属矿的主要成分,经过一系列反应可得到化合物B和单质C.单质C可与E的浓溶液发生反应,G为蓝色沉淀.请回答下列问题:
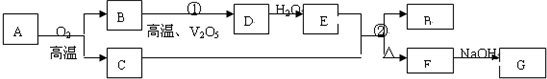
(1)写出下列物质的化学式:B 、E 、G
(2)反应②的化学方程式是 .
(3)将0.23molB和0.11molO2放入容积为1L的密闭容器中,发生反应①,在一定温度下,反应达到平衡.得到0.12molD,则反应的平衡常数K= .若温度不变,再加入0.50molO2后重新达到平衡,则B的平衡浓度 (填“增大”、“不变”或“减小”),氧气的转化率 (填“升高”、“不变”或“降低”),D的体积分数 (填“增大”、“不变”或“减小”).

(1)写出下列物质的化学式:B
(2)反应②的化学方程式是
(3)将0.23molB和0.11molO2放入容积为1L的密闭容器中,发生反应①,在一定温度下,反应达到平衡.得到0.12molD,则反应的平衡常数K=
考点:无机物的推断,含硫物质的性质及综合应用
专题:推断题,氧族元素
分析:“G为蓝色沉淀”是本题的突破口,应为Cu(OH)2,因此此题可以用逆向推断的方法做,不难看出,F为CuSO4;从B→D→E,可推断为NO→NO2→HNO3或SO2→SO3 →H2SO4等.因为B→D的转化需用催化剂,可判定B为SO2,D为SO3,E为H2SO4,A应为Cu2S,反应②为浓硫酸和铜在加热条件下的反应,反应的化学方程式为Cu+2H2SO4(浓)
CuSO4+SO2+2H2O,从平衡移动的角度计算平衡时各物质的浓度,进而计算化学平衡常数以及判断各物质的浓度的变化.
| ||
解答:
解:“G为蓝色沉淀”是本题的突破口,应为Cu(OH)2,因此此题可以用逆向推断的方法做,不难看出,F为CuSO4;从B→D→E,可推断为NO→NO2→HNO3或SO2→SO3 →H2SO4等.因为B→D的转化需用催化剂,可判定B为SO2,D为SO3,E为H2SO4,A应为Cu2S,
(1)由以上分析可知B、E、G分别为SO2、H2SO4、Cu(OH)2,故答案为:SO2;H2SO4;Cu(OH)2;
(2)反应②为浓硫酸和铜在加热条件下的反应,反应的化学方程式为Cu+2H2SO4(浓)
CuSO4+SO2+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2+2H2O;
(3)依据化学方程式:
2SO2+O2
2SO3
c(mol/L):起始 0.23 0.11 0
转化 0.12 0.06 0.12
第一次 平衡 0.11 0.05 0.12
可以求得:K=
=23.8(mol-1?L),
恒温、恒容条件下,加入0.50 mol O2后,根据勒夏特列原理,平衡右移,SO2的物质的量减少,体积分数减小,O2本身的转化率降低.设此时转化xmol/L的 O2,
2SO2+O2
2SO3
(mol/L):起始 0.11 0.05+0.50 0.12
转化 2x x 2x
第二次平衡 0.11-2x 0.55-x 0.12+2x
第一次平衡时SO3的体积分数为:
=0.429,
只要注意到可逆反应中任意物质的浓度不可能为零的特点,x的最大极限值为0.055 mol/L,所以第二次平衡时SO3的体积分数最大为:
=
=0.380,
显然,体积分数减小了.
故答案为:23.8 mol-1?L;减小;降低;减小.
(1)由以上分析可知B、E、G分别为SO2、H2SO4、Cu(OH)2,故答案为:SO2;H2SO4;Cu(OH)2;
(2)反应②为浓硫酸和铜在加热条件下的反应,反应的化学方程式为Cu+2H2SO4(浓)
| ||
| ||
(3)依据化学方程式:
2SO2+O2
| ||
| △ |
c(mol/L):起始 0.23 0.11 0
转化 0.12 0.06 0.12
第一次 平衡 0.11 0.05 0.12
可以求得:K=
| 0.122 |
| 0.112×0.05 |
恒温、恒容条件下,加入0.50 mol O2后,根据勒夏特列原理,平衡右移,SO2的物质的量减少,体积分数减小,O2本身的转化率降低.设此时转化xmol/L的 O2,
2SO2+O2
| ||
| △ |
(mol/L):起始 0.11 0.05+0.50 0.12
转化 2x x 2x
第二次平衡 0.11-2x 0.55-x 0.12+2x
第一次平衡时SO3的体积分数为:
| 0.12 |
| 0.11+0.05+0.12 |
只要注意到可逆反应中任意物质的浓度不可能为零的特点,x的最大极限值为0.055 mol/L,所以第二次平衡时SO3的体积分数最大为:
| 0.12+2x |
| 0.11+0.55-x |
| 0.23 |
| 0.605 |
显然,体积分数减小了.
故答案为:23.8 mol-1?L;减小;降低;减小.
点评:本题考查较为综合,题目难度较大,注意根据物质的特殊颜色推断物质的可能性,用逆推的方法进行推断,把握常见元素化合物的性质.

练习册系列答案
相关题目
纯水在25℃时的氢离子浓度与90℃时的氢离子浓度的关系是( )
| A、大于 | B、等于 |
| C、小于 | D、不能肯定 |
下列实验事实与平衡移动无关的是( )
| A、氯气难溶于饱和食盐水 |
| B、用加压的方法促进CO2在水中的溶解 |
| C、FeCl3+3KSCN?Fe(SCN)3+KCl,向体系中加入KCl固体 |
| D、合成氨工业中,及时将氨气液化移出 |
某有机物的结构简式为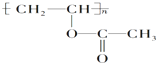 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )
 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )| A、1mol该有机物与NaOH溶液完全反应时,消耗NaOH 1mol |
| B、该有机物水解所得产物能发生取代反应 |
| C、该有机物可通过加聚反应生成 |
| D、该有机物的单体只有一种且能使溴水褪色 |
 能源、材料和信息是现代社会的三大“支柱”.
能源、材料和信息是现代社会的三大“支柱”.