题目内容
叠氮化物是一类重要化合物'在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,其中氢叠氮酸(HN3)是一种弱酸,如图甲为分子结构示意图.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):
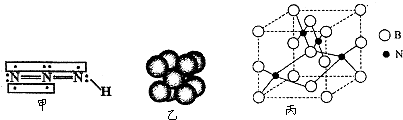
N2H4+HNO2=2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N3-.试回答下列问题:
(1)下列说法正确的是 (选填序号).
A.酸性:HNO2>HNO3
B.N2H4中两个氮原子采用的都是sp2杂化
C.HN3、H2O都是极性分子
D.N2H4沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮化物能与Fe3+、Cu2+及Co3+等形成配合物,如:[Co(N3)(NH3)5]SO4,在该配合物中钴显 价,根据价层电子对互斥理论可知SO2-4的立体构型为: ,写出钴原子在基态时的核外电子排布式:
(3)由叠氮化钠(NaN3)热分解可得光谱纯N2:2NaN3(S)=2Na(l)+3N2(g),下列说法正确的是 (选填序号).
A.NaN3与KN3结构类似,前者晶格能较小
B.钠晶胞结构如图乙,晶胞中分摊2个钠原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮元素的电负性小
(4)与N-3互为等电子体的分子有: (举两例)
(5)人造立方氮化硼的硬度仅次于金刚石而远远高于其他材料,因此它与金刚石统称为超硬材料.立方氮化硼晶胞如图丙所示,试分析:
①该晶体的类型为 晶体.
②晶体中每个N原子同时吸引 个B原子.
③设该晶体的摩尔质量为M g.mol-1,晶体的密度为p g?cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的B原子之间的距离为 cm.

N2H4+HNO2=2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N3-.试回答下列问题:
(1)下列说法正确的是
A.酸性:HNO2>HNO3
B.N2H4中两个氮原子采用的都是sp2杂化
C.HN3、H2O都是极性分子
D.N2H4沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮化物能与Fe3+、Cu2+及Co3+等形成配合物,如:[Co(N3)(NH3)5]SO4,在该配合物中钴显
(3)由叠氮化钠(NaN3)热分解可得光谱纯N2:2NaN3(S)=2Na(l)+3N2(g),下列说法正确的是
A.NaN3与KN3结构类似,前者晶格能较小
B.钠晶胞结构如图乙,晶胞中分摊2个钠原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮元素的电负性小
(4)与N-3互为等电子体的分子有:
(5)人造立方氮化硼的硬度仅次于金刚石而远远高于其他材料,因此它与金刚石统称为超硬材料.立方氮化硼晶胞如图丙所示,试分析:
①该晶体的类型为
②晶体中每个N原子同时吸引
③设该晶体的摩尔质量为M g.mol-1,晶体的密度为p g?cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的B原子之间的距离为
考点:晶胞的计算,判断简单分子或离子的构型,配合物的成键情况,“等电子原理”的应用,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)A、HNO2为弱酸,而HNO3是强酸;
B、N2H4中氮原子最外层有5个电子,形成三对共用电子对,另外还有一对孤电子对,氮原子采用的都是sp3杂化;
C、HN3、H2O中都有孤电子对,所以都是极性分子;
D、氢键主要存在于N、F、O三种元素的氢化物分子之间,可使物质的熔沸点变大,N2H4沸点高达113.5℃,可以说明肼分子间可形成氢键.
(2)在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,可以算得钴的化合价,SO2-4中S原子采用sp3杂化方式,可知SO2-4的立体构型为正四面体,钴是27号元素,根据核外电子排布规律可以写出基态时的核外电子排布式;
(3)A、NaN3与KN3结构类似,Na+半径小于K+,所以NaN3的晶格能比BKN3大;
B、钠晶胞中,在8个顶点上各有一个原子,体心上还有一个,所以晶胞中钠原子的个数为:8×
+1=2;
C、氮原子的最外层P轨道有3个电子,处于半充满状态,是一种较稳定结构,所以它的第一电离能大于氧;
D、氮气常温下很稳定,是因为氮气是双原子分子,两个氮原子之间存在N≡N键,不易断裂,与元素的电负性无关.
(4)在N-3中,价电子数为16,根据等电子体原理,可以写出等电子体的分子;
(5)①、由于立方氮化硼的硬度大,且是立方体网状结构,所以它是原子晶体;
②、根据题目中的图,可以看出每个N原子同时吸引B原子的个数;
③、根据晶体的摩尔质量,晶体的密度可以求得晶胞的体积,再根据晶胞中B原子的分布情况,可以求得两个距离最近的B原子之间的距离.
B、N2H4中氮原子最外层有5个电子,形成三对共用电子对,另外还有一对孤电子对,氮原子采用的都是sp3杂化;
C、HN3、H2O中都有孤电子对,所以都是极性分子;
D、氢键主要存在于N、F、O三种元素的氢化物分子之间,可使物质的熔沸点变大,N2H4沸点高达113.5℃,可以说明肼分子间可形成氢键.
(2)在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,可以算得钴的化合价,SO2-4中S原子采用sp3杂化方式,可知SO2-4的立体构型为正四面体,钴是27号元素,根据核外电子排布规律可以写出基态时的核外电子排布式;
(3)A、NaN3与KN3结构类似,Na+半径小于K+,所以NaN3的晶格能比BKN3大;
B、钠晶胞中,在8个顶点上各有一个原子,体心上还有一个,所以晶胞中钠原子的个数为:8×
| 1 |
| 8 |
C、氮原子的最外层P轨道有3个电子,处于半充满状态,是一种较稳定结构,所以它的第一电离能大于氧;
D、氮气常温下很稳定,是因为氮气是双原子分子,两个氮原子之间存在N≡N键,不易断裂,与元素的电负性无关.
(4)在N-3中,价电子数为16,根据等电子体原理,可以写出等电子体的分子;
(5)①、由于立方氮化硼的硬度大,且是立方体网状结构,所以它是原子晶体;
②、根据题目中的图,可以看出每个N原子同时吸引B原子的个数;
③、根据晶体的摩尔质量,晶体的密度可以求得晶胞的体积,再根据晶胞中B原子的分布情况,可以求得两个距离最近的B原子之间的距离.
解答:
解:(1)A、HNO2为弱酸,而HNO3是强酸,故A错误;
B、N2H4中氮原子最外层有5个电子,形成三对共用电子对,另外还有一对孤电子对,氮原子采用的都是sp3杂化,故B错误;
C、HN3、H2O中都有孤电子对,所以都是极性分子,故C正确;
D、氢键主要存在于N、F、O三种元素的氢化物分子之间,可使物质的熔沸点变大,N2H4沸点高达113.5℃,可以说明肼分子间可形成氢键,故D正确.
故答案为CD;
(2)在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,可以算得钴的化合价为:+3价,SO2-4中S原子采用sp3杂化方式,可知SO2-4的立体构型为正四面体,钴是27号元素,根据核外电子排布规律可以写出基态时的核外电子排布式为:1s22s22p63s23p63d74s2.
故答案为:+3;正四面体;1s22s22p63s23p63d74s2;
(3)A、NaN3与KN3结构类似,Na+半径小于K+,所以NaN3的晶格能比BKN3大,故A错误;
B、钠晶胞中,在8个顶点上各有一个原子,体心上还有一个,所以晶胞中钠原子的个数为:8×
+1=2,故B正确;
C、子的最外层P轨道有3个电子,处于半充满状态,是一种较稳定结构,所以它的第一电离能大于氧,故C正确;
D、常温下很稳定,是因为氮气是双原子分子,两个氮原子之间存在N≡N键,不易断裂,与元素的电负性无关,故D错误.
故答案为BC;
(4)在N-3中,价电子数为16,根据等电子体原理,可以写出与N-3互为电子体的分子为N2O、CO2、CS2、BeF2、BeCl2等.
故答案为:N2O、CO2、CS2、BeF2、BeCl2等;
(5)①、由于立方氮化硼的硬度大,且是立方体网状结构,所以它是原子晶体,故答案为:原子;
②、根据题目中的图,可以看出每个N原子同时吸引4个B原子,故答案为:4;
③、根据晶体的摩尔质量,晶体的密度可以求得晶胞的体积,再根据晶胞中B原子的分布情况,可以求得两个距离最近的B原子之间的距离
∵由图可知每个晶胞中含4个B原子和4个N原子
∴每个晶胞的质量=4M/NA
∴晶胞的体积V=
∴晶胞的边长=
=
在图丙的晶胞中,位于侧棱中点和顶点之间两B原子距离最近,晶体中两个距离最近的B原子之间的距离=
×晶胞的边长=
×
=
,故答案 为:
B、N2H4中氮原子最外层有5个电子,形成三对共用电子对,另外还有一对孤电子对,氮原子采用的都是sp3杂化,故B错误;
C、HN3、H2O中都有孤电子对,所以都是极性分子,故C正确;
D、氢键主要存在于N、F、O三种元素的氢化物分子之间,可使物质的熔沸点变大,N2H4沸点高达113.5℃,可以说明肼分子间可形成氢键,故D正确.
故答案为CD;
(2)在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,可以算得钴的化合价为:+3价,SO2-4中S原子采用sp3杂化方式,可知SO2-4的立体构型为正四面体,钴是27号元素,根据核外电子排布规律可以写出基态时的核外电子排布式为:1s22s22p63s23p63d74s2.
故答案为:+3;正四面体;1s22s22p63s23p63d74s2;
(3)A、NaN3与KN3结构类似,Na+半径小于K+,所以NaN3的晶格能比BKN3大,故A错误;
B、钠晶胞中,在8个顶点上各有一个原子,体心上还有一个,所以晶胞中钠原子的个数为:8×
| 1 |
| 8 |
C、子的最外层P轨道有3个电子,处于半充满状态,是一种较稳定结构,所以它的第一电离能大于氧,故C正确;
D、常温下很稳定,是因为氮气是双原子分子,两个氮原子之间存在N≡N键,不易断裂,与元素的电负性无关,故D错误.
故答案为BC;
(4)在N-3中,价电子数为16,根据等电子体原理,可以写出与N-3互为电子体的分子为N2O、CO2、CS2、BeF2、BeCl2等.
故答案为:N2O、CO2、CS2、BeF2、BeCl2等;
(5)①、由于立方氮化硼的硬度大,且是立方体网状结构,所以它是原子晶体,故答案为:原子;
②、根据题目中的图,可以看出每个N原子同时吸引4个B原子,故答案为:4;
③、根据晶体的摩尔质量,晶体的密度可以求得晶胞的体积,再根据晶胞中B原子的分布情况,可以求得两个距离最近的B原子之间的距离
∵由图可知每个晶胞中含4个B原子和4个N原子
∴每个晶胞的质量=4M/NA
∴晶胞的体积V=
| 4M/NA |
| ρ |
∴晶胞的边长=
| 3 | V |
| 3 |
| ||
在图丙的晶胞中,位于侧棱中点和顶点之间两B原子距离最近,晶体中两个距离最近的B原子之间的距离=
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| ||
| 3 |
| ||
| 3 |
| ||
点评:本题考查了学生对原子的杂化方式、分子的空间结构、等电子体、晶体的结构及晶胞的计算等知识的掌握情况,具有一定的综合性,对学生综合能力有一定的要求.中等难度.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
下列离子在溶液中能够共存并且在加入少量的Na2O2固体后原离子浓度能基本保持不变的是( )
| A、NH4+、Ba2+、Cl-、NO3- |
| B、K+、AlO2-、Cl-、SO42- |
| C、Ca2+、Mg2+、NO3-、HCO3- |
| D、Na+、Cl-、HSO3-、NO3- |
某有机物的结构简式为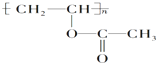 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )
 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )| A、1mol该有机物与NaOH溶液完全反应时,消耗NaOH 1mol |
| B、该有机物水解所得产物能发生取代反应 |
| C、该有机物可通过加聚反应生成 |
| D、该有机物的单体只有一种且能使溴水褪色 |
根据热化学方程式:S(s)+O2(g)═SO2(g)△H=a kJ?mol-1(a=-297.2),下列说法中不正确的是( )
| A、S(s)在氧气中燃烧的反应是放热反应 |
| B、S(s)+O2(g)═SO2(g)△H=b kJ?mol-1,则a<b |
| C、1mol SO2(g)所具有的能量低于1mol S(s)与1mol O2(g)所具有的能量之和 |
| D、16g固体硫在氧气中充分燃烧,可放出148.6kJ的热量 |