题目内容
在HCN溶液中有如下平衡:HCN?H++CN-,向该溶液中加入少量的下列物质后,一定能使电离平衡向右移动的是( )
| A、NaOH溶液 |
| B、硫酸溶液 |
| C、NaCN溶液 |
| D、盐酸溶液 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:影响平衡移动的因素:浓度、同离子效应等,根据化学平衡移动原理来确定电离平衡的移动方向.
解答:
解:A、加入氢氧化钠溶液,消耗氢离子,会使平衡:HCN?H++CN-正向移动,故A正确;
B、加入硫酸溶液,增大了氢离子浓度,会使平衡:HCN?H++CN-逆向移动,故B错误;
C、加入NaCN溶液,增大了CN-的浓度,会使平衡:HCN?H++CN-逆向移动,故C错误;
D、加入盐酸溶液,增大了氢离子浓度,会使平衡:HCN?H++CN-逆向移动,故D错误;
故选A.
B、加入硫酸溶液,增大了氢离子浓度,会使平衡:HCN?H++CN-逆向移动,故B错误;
C、加入NaCN溶液,增大了CN-的浓度,会使平衡:HCN?H++CN-逆向移动,故C错误;
D、加入盐酸溶液,增大了氢离子浓度,会使平衡:HCN?H++CN-逆向移动,故D错误;
故选A.
点评:本题考查学生弱电解质的电离平衡的移动知识,可以根据化学平衡移动原理来回答,难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
常温下pH=3的盐酸与pH=9的NaOH溶液等体积混合(假设体积等于混合前两溶液体积和),混合溶液中c(H+)的计算式是( )
A、
| ||
B、
| ||
C、
| ||
| D、以上计算式都不对 |
纯水在25℃时的氢离子浓度与90℃时的氢离子浓度的关系是( )
| A、大于 | B、等于 |
| C、小于 | D、不能肯定 |
下列离子在溶液中能够共存并且在加入少量的Na2O2固体后原离子浓度能基本保持不变的是( )
| A、NH4+、Ba2+、Cl-、NO3- |
| B、K+、AlO2-、Cl-、SO42- |
| C、Ca2+、Mg2+、NO3-、HCO3- |
| D、Na+、Cl-、HSO3-、NO3- |
用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A、
| ||
B、
| ||
| C、c(H+)和c(OH-)的乘积 | ||
| D、OH-的物质的量 |
下列事实不能用勒夏特列原理解释的是( )
| A、恒温密闭容器中NO2和N2O4形成的平衡体系,减小体积,体系颜色加深 |
| B、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| C、滴加酚酞的氨水中加入氯化铵固体后红色变浅 |
| D、工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
下列实验事实与平衡移动无关的是( )
| A、氯气难溶于饱和食盐水 |
| B、用加压的方法促进CO2在水中的溶解 |
| C、FeCl3+3KSCN?Fe(SCN)3+KCl,向体系中加入KCl固体 |
| D、合成氨工业中,及时将氨气液化移出 |
某有机物的结构简式为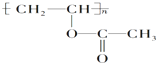 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )
 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )| A、1mol该有机物与NaOH溶液完全反应时,消耗NaOH 1mol |
| B、该有机物水解所得产物能发生取代反应 |
| C、该有机物可通过加聚反应生成 |
| D、该有机物的单体只有一种且能使溴水褪色 |