题目内容
13.某元素R的最高正价与最低负价的代数和为0,由此可以判断( )| A. | R原子核外一定有4个电子层 | |
| B. | R原子最外层电子数一定为4 | |
| C. | R的气态氧化物比电子层数相同的其他非金属元素的气态氢化物稳定 | |
| D. | R元素气态氢化物的化学式为H2R |
分析 设主族元素R的最高正化合价为x,则最低负价x-8,故有x+(x-8)=0,解得x=+4,该元素处于ⅣA族,以此解答该题.
解答 解:设主族元素R的最高正化合价为x,则最低负价x-8,故有x+(x-8)=0,解得x=+4,该元素处于ⅣA族,
A.不一定为第四周期元素,则不一定有4个电子层,故A错误;
B.由以上分析可知,R原子的最外层电子数一定为4,故B正确;
C.R为ⅣA族元素,非金属性比同周期ⅦA族弱,则气态氢化物较ⅦA族弱,故C错误;
D.R的最低负化合价为-4,氢化物化学式为H4R,故D错误.
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,侧重于学生的分析能力的考查,关键是清楚元素的最高价和最低负价的关系,难度不大.

练习册系列答案
相关题目
3.下列各组离子在溶液中能大量共存,且通入足量SO2气体后,最终溶液仍然保持澄清的离子组是( )
| A. | Ba2+、Na+、Cl-、NO3- | B. | Fe3+、Ba2+、Cl-、I- | ||
| C. | Na+、NH4+、SO42-、OH- | D. | K+、Ca2+、HCO3-、Cl- |
4.已知H2O$\stackrel{高能射线}{→}$H2O++e-,e-被水分子形成的“网”所捕获.下列有关说法正确的是( )
| A. | H2O和H2O+互为同分异构体 | B. | H2O+有较强的氧化性 | ||
| C. | 水分子形成的“网”是一种新化合物 | D. | H2O(s)→H2O(l)→H2O(g) |
1.下列各容器中盛有海水,其中铁发生腐蚀由快到慢的顺序是( )


| A. | ①>②>③ | B. | ③>②>① | C. | ③>①>>② | D. | ②>①>③ |
20.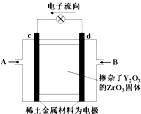 如图所示,以稀土金属材料作惰性电极,在两极上分别通入甲烷与空气,电解质为掺杂了Y2O3的ZrO3固体,它在高温下能传导O2-.下列说法正确的是( )
如图所示,以稀土金属材料作惰性电极,在两极上分别通入甲烷与空气,电解质为掺杂了Y2O3的ZrO3固体,它在高温下能传导O2-.下列说法正确的是( )
 如图所示,以稀土金属材料作惰性电极,在两极上分别通入甲烷与空气,电解质为掺杂了Y2O3的ZrO3固体,它在高温下能传导O2-.下列说法正确的是( )
如图所示,以稀土金属材料作惰性电极,在两极上分别通入甲烷与空气,电解质为掺杂了Y2O3的ZrO3固体,它在高温下能传导O2-.下列说法正确的是( )| A. | c电极名称为负极,气体A为空气 | |
| B. | d电极上发生反应:CH4-8e-+4O2-═CO2+2H2O | |
| C. | O2-向c电极移动 | |
| D. | 用此装置作电源电解精炼铜,d电极与粗铜相连 |