题目内容
实验室有黄铜(铜和锌两种金属的混合物)粉末.课外化学兴趣小组欲利用给出的实验仪器及试剂,测定该样品中锌的质量分数.
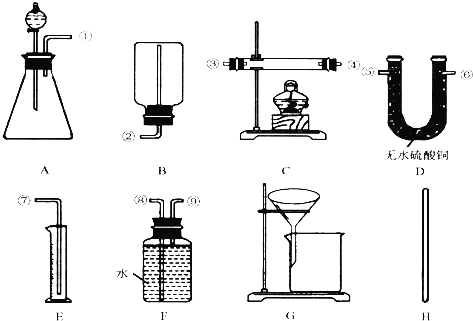
Ⅰ.除托盘天平必用外,供选择的实验装置如图所示:
Ⅱ.实验中可测得的数据:
黄铜的质量a g;充分反应后在标准状况下生成氢气的体积为b L;反应前仪器和药品的质量为c g;充分反应后剩余固体的质量为d g;充分反应后仪器和药品的质量为e g.
(1)实验中可供选择的药品除样品外,还有:足量的浓硫酸、足量的稀硫酸、氧化铜,你认为一定要用到的药品是 .
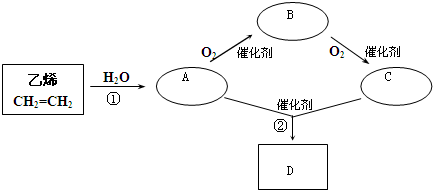
(2)甲同学实验中使用了A、E、F三种装置,组装时接口编号的连接顺序为: ,实验结束时读数时应注意 ,写出合金中锌的质量分数的计算式 .
(3)乙同学实验中测得数据为:黄铜的质量a g;充分反应后剩余固体的质量为d g.他在实验中使用了上图中 装置(填序号A…).
(4)丙同学实验中只使用了A装置,他需要测得的实验数据(从上述Ⅱ可测得的数据中选取,用符号a…表示): ,但用该数据求算的结果可能会有误差.
(5)丁同学设计了另一种测定方法,他考虑使用A、C、D三种装置,并使用了足量的稀硫酸和氧化铜两种试剂,除测定黄铜的质量a g外,还测定C装置反应前仪器和药品的质量为c g、充分反应后仪器和药品的质量为e g.他 填“能”或“不能”)测定出合金中锌的质量分数,因为 .
Ⅰ.除托盘天平必用外,供选择的实验装置如图所示:

Ⅱ.实验中可测得的数据:
黄铜的质量a g;充分反应后在标准状况下生成氢气的体积为b L;反应前仪器和药品的质量为c g;充分反应后剩余固体的质量为d g;充分反应后仪器和药品的质量为e g.
(1)实验中可供选择的药品除样品外,还有:足量的浓硫酸、足量的稀硫酸、氧化铜,你认为一定要用到的药品是
(2)甲同学实验中使用了A、E、F三种装置,组装时接口编号的连接顺序为:
(3)乙同学实验中测得数据为:黄铜的质量a g;充分反应后剩余固体的质量为d g.他在实验中使用了上图中
(4)丙同学实验中只使用了A装置,他需要测得的实验数据(从上述Ⅱ可测得的数据中选取,用符号a…表示):
(5)丁同学设计了另一种测定方法,他考虑使用A、C、D三种装置,并使用了足量的稀硫酸和氧化铜两种试剂,除测定黄铜的质量a g外,还测定C装置反应前仪器和药品的质量为c g、充分反应后仪器和药品的质量为e g.他
考点:探究物质的组成或测量物质的含量
专题:
分析:利用锌与稀硫酸反应生成氢气,并通过排水法测定生成的氢气的体积来计算混合物中的锌的量,从而测定该样品中锌的质量分数,所以选择的仪器连接顺序为①⑨⑧⑦,据此分析解答;
(1)要使锌发生反应生成氢气,则实验时必须用到的化学试剂是稀硫酸;
(2)根据发生装置、排水装置、收集装置进行排序;实验结束时读数时应注意恢复至室温、调节E、F中液面相平、视线与E中凹液面相切;根据氢气的体积计算锌的质量,再根据质量分数公式计算锌的质量分数;
(3)乙同学实验中测得的数据为a和e,说明乙同学能得到反应后的固体质量;
(4)丙同学实验中只选用了A装置,要想得到锌的质量,必须知道样品质量、反应前仪器和药品的总质量、充分反应后仪器和药品的总质量;
(5)氢气不能完全和氧化铜反应,导致氢气的量不准确.
(1)要使锌发生反应生成氢气,则实验时必须用到的化学试剂是稀硫酸;
(2)根据发生装置、排水装置、收集装置进行排序;实验结束时读数时应注意恢复至室温、调节E、F中液面相平、视线与E中凹液面相切;根据氢气的体积计算锌的质量,再根据质量分数公式计算锌的质量分数;
(3)乙同学实验中测得的数据为a和e,说明乙同学能得到反应后的固体质量;
(4)丙同学实验中只选用了A装置,要想得到锌的质量,必须知道样品质量、反应前仪器和药品的总质量、充分反应后仪器和药品的总质量;
(5)氢气不能完全和氧化铜反应,导致氢气的量不准确.
解答:
解:(1)要想分离铜和锌,只能根据两种金属的活泼性不同,使活泼金属和酸反应,另一种金属和酸不反应,不仅能将两种金属分开,还能根据反应计算锌的质量,则实验时必须用到的化学试剂为稀硫酸,故答案为:稀硫酸;
(2)根据发生装置、排水装置、收集装置进行排序,且排水装置中短管进气长管排水,所以其排列顺序为:①⑨⑧⑦;实验结束时读数时应注意恢复至室温、调节E、F中液面相平、视线与E中凹液面相切;根据氢气的体积可以得到锌的质量,再根据质量分数公式得锌的质量分数=
=
,
故答案为:①⑨⑧⑦;恢复至室温、调节E、F中液面相平、视线与E中凹液面相切;
;
(3)乙同学实验中测得的数据为a和e,说明乙同学能得到反应后的固体质量,要想得到反应后的固体必须采用过滤的方法制取,过滤过程中要用玻璃棒引流,所以他使用的实验装置有AGH,故答案为:AGH;
(4)丙同学实验中只选用了A装置,说明他只能知道A装置反应前后的质量和样品的质量,他要测得的数据有a、c、e,故答案为:a、c、e;
(5)用氢气还原氧化铜时,首先要通氢排除装置中的氧气,反应后还要通氢防止铜被氧化,所以导致氢气的量测量不准,则无法计算锌的质量,所以不能,
故答案为:不能;因为氢气还原氧化铜时,排除装置中的空气及冷却装置都要消耗氢气,而且部分氢气未反应即排出,所以不可能通过计算得出氢气的产量,也无法计算锌的质量.
(2)根据发生装置、排水装置、收集装置进行排序,且排水装置中短管进气长管排水,所以其排列顺序为:①⑨⑧⑦;实验结束时读数时应注意恢复至室温、调节E、F中液面相平、视线与E中凹液面相切;根据氢气的体积可以得到锌的质量,再根据质量分数公式得锌的质量分数=
| ||
| a |
| 65b |
| 22.4a |
故答案为:①⑨⑧⑦;恢复至室温、调节E、F中液面相平、视线与E中凹液面相切;
| 65b |
| 22.4a |
(3)乙同学实验中测得的数据为a和e,说明乙同学能得到反应后的固体质量,要想得到反应后的固体必须采用过滤的方法制取,过滤过程中要用玻璃棒引流,所以他使用的实验装置有AGH,故答案为:AGH;
(4)丙同学实验中只选用了A装置,说明他只能知道A装置反应前后的质量和样品的质量,他要测得的数据有a、c、e,故答案为:a、c、e;
(5)用氢气还原氧化铜时,首先要通氢排除装置中的氧气,反应后还要通氢防止铜被氧化,所以导致氢气的量测量不准,则无法计算锌的质量,所以不能,
故答案为:不能;因为氢气还原氧化铜时,排除装置中的空气及冷却装置都要消耗氢气,而且部分氢气未反应即排出,所以不可能通过计算得出氢气的产量,也无法计算锌的质量.
点评:本题考查了探究物质的组成或含量的测定,明确测量原理是解本题关键,知道氢气还原氧化铜的操作步骤,难度较大.

练习册系列答案
相关题目
常温下,某0.01mol?L-1一元酸HX的电离常数K=1.0×10-6,测得其pH=4.下列有关推断不正确的是( )
A、该溶液中
| ||
| B、等物质的量浓度、等体积HX溶液和氨水混合,混合液一定呈中性 | ||
| C、等体积的pH=11的NaOH溶液和pH=3的HX的溶液混合,溶液呈酸性 | ||
| D、在HX溶液中滴加烧碱溶液,可能存在:c(Na+)>c(OH-)>c(X-)>c(H+) |
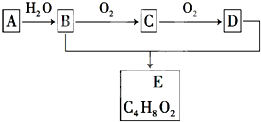 有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平.A、B、C、D、E有如图所示的关系.则下列推断不正确的是( )
有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平.A、B、C、D、E有如图所示的关系.则下列推断不正确的是( )| A、鉴别A和甲烷可选择酸性高锰酸钾溶液 | ||
| B、B、D均既能与金属钠反应也能与NaHCO3反应 | ||
| C、物质C的结构简式为CH3CHO | ||
D、B+D→E的化学方程式为CH3CH2OH+CH3COOH
|
短周期主族元素X、Y、Z、W、M,在周期表中相对位置如下图,且它们原子序数依次增大,Y的气态氢化物溶于水显碱性.下列说法正确的是( )
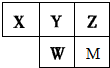

| A、原子半径大小:r(X)>r(Y)>r(W)>r(Z) |
| B、甲物质由M和Z元素组成,溶于水后一定得到甲的水溶液 |
| C、氢化物的稳定性:X>Y;氧化物水化物的酸性:W>Y>M |
| D、Y的气态氢化物(YH3)的空间结构为三角锥形 |