题目内容
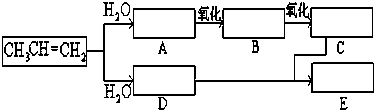
有一种重要的化工产品,也是一种常见的有机溶剂D,它是一种不易溶于水的、有香味的油状液体.它可以用乙烯为原料按下列流程生产制得.
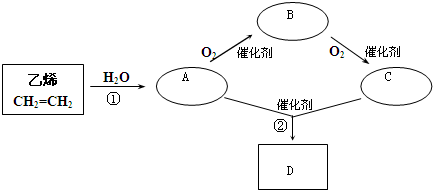
请回答下列问题:
(1)指明反应的类型:① 反应;② 反应
(2)D有多种同分异构体,请任意写出两种结构简式: 、
(3)A、B分子中所含官能团名称分别为 、
(4)完成下列的反应方程式:
①CH2=CH2→A
②B→C
③A+C→D .

请回答下列问题:
(1)指明反应的类型:①
(2)D有多种同分异构体,请任意写出两种结构简式:
(3)A、B分子中所含官能团名称分别为
(4)完成下列的反应方程式:
①CH2=CH2→A
②B→C
③A+C→D
考点:有机物的推断
专题:有机物的化学性质及推断
分析:乙烯和水发生加成反应生成乙醇,则A结构简式为CH3CH2OH,乙醇被催化氧化生成乙醛,则B结构简式为CH3CHO,乙醛被催化氧化生成乙酸,则C结构简式为CH3COOH,乙醇和乙酸在浓硫酸催化剂、加热条件下发生酯化反应生成乙酸乙酯,则D结构简式为CH3COOCH2CH3,据此分析解答.
解答:
解:乙烯和水发生加成反应生成乙醇,则A结构简式为CH3CH2OH,乙醇被催化氧化生成乙醛,则B结构简式为CH3CHO,乙醛被催化氧化生成乙酸,则C结构简式为CH3COOH,乙醇和乙酸在浓硫酸催化剂、加热条件下发生酯化反应生成乙酸乙酯,则D结构简式为CH3COOCH2CH3,
(1)通过以上分析知,乙烯和水发生加成反应生成乙醇,所以该反应类型为加成反应,乙醇和乙酸发生酯化反应或取代反应生成乙酸乙酯,所以该反应类型是酯化反应或取代反应,
故答案为:加成;取代或酯化;
(2)D是乙酸乙酯,其同分异构体有CH3CH2CH2COOH、(CH3)2CHCOOH、CH3CH2COOCH3、HCOOCH2CH2CH3、HCOOCH(CH3),故答案为:CH3CH2CH2COOH、(CH3)2CHCOOH、CH3CH2COOCH3、HCOOCH2CH2CH3、HCOOCH(CH3);
(3)A结构简式为CH3CH2OH,B结构简式为CH3CHO,则A、B中官能团分别为羟基、醛基,故答案为:羟基;醛基;
(4)①在催化剂条件下,乙烯和水发生加成反应生成乙醇,反应方程式为CH2=CH2+H2O
CH3CH2OH,故答案为:CH2=CH2+H2O
CH3CH2OH;
②B是乙醛、C是乙酸,乙醛发生氧化反应生成乙酸,反应方程式为2CH3CHO+O2
2CH3COOH,故答案为:2CH3CHO+O2
2CH3COOH;
③A是乙醇、C是乙酸,二者发生取代反应或酯化反应生成乙酸乙酯,反应方程式为CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O.
(1)通过以上分析知,乙烯和水发生加成反应生成乙醇,所以该反应类型为加成反应,乙醇和乙酸发生酯化反应或取代反应生成乙酸乙酯,所以该反应类型是酯化反应或取代反应,
故答案为:加成;取代或酯化;
(2)D是乙酸乙酯,其同分异构体有CH3CH2CH2COOH、(CH3)2CHCOOH、CH3CH2COOCH3、HCOOCH2CH2CH3、HCOOCH(CH3),故答案为:CH3CH2CH2COOH、(CH3)2CHCOOH、CH3CH2COOCH3、HCOOCH2CH2CH3、HCOOCH(CH3);
(3)A结构简式为CH3CH2OH,B结构简式为CH3CHO,则A、B中官能团分别为羟基、醛基,故答案为:羟基;醛基;
(4)①在催化剂条件下,乙烯和水发生加成反应生成乙醇,反应方程式为CH2=CH2+H2O
| 催化剂 |
| 催化剂 |
②B是乙醛、C是乙酸,乙醛发生氧化反应生成乙酸,反应方程式为2CH3CHO+O2
| 催化剂 |
| 催化剂 |
③A是乙醇、C是乙酸,二者发生取代反应或酯化反应生成乙酸乙酯,反应方程式为CH3COOH+CH3CH2OH
| 催化剂 |
| △ |
| 催化剂 |
| △ |
点评:本题考查有机物推断,侧重考查分析、推断能力,涉及烯烃、醇、醛、羧酸、酯之间的转化,熟练掌握常见有机物的官能团及其性质,会根据结构确定性质或根据性质推断其结构,题目难度不大.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
 X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素.其中Y、W位于同一主族,Z、W位于同一周期;Y所组成的单质和氢化物中分别有一种具有漂白性;Z是同一周期中金属性最强的元素,X的某同位素原子的质子数与中子数相等且应用于核聚变反应.请回答下列问题:
X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素.其中Y、W位于同一主族,Z、W位于同一周期;Y所组成的单质和氢化物中分别有一种具有漂白性;Z是同一周期中金属性最强的元素,X的某同位素原子的质子数与中子数相等且应用于核聚变反应.请回答下列问题:
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
