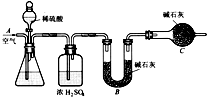
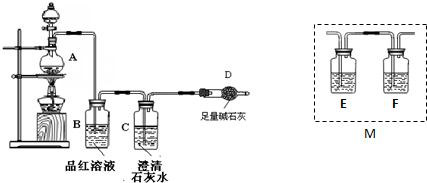
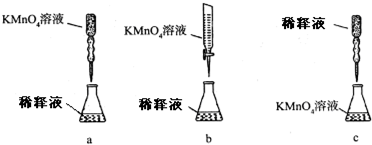
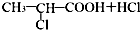题目内容
常温下,某0.01mol?L-1一元酸HX的电离常数K=1.0×10-6,测得其pH=4.下列有关推断不正确的是( )
A、该溶液中
| ||
| B、等物质的量浓度、等体积HX溶液和氨水混合,混合液一定呈中性 | ||
| C、等体积的pH=11的NaOH溶液和pH=3的HX的溶液混合,溶液呈酸性 | ||
| D、在HX溶液中滴加烧碱溶液,可能存在:c(Na+)>c(OH-)>c(X-)>c(H+) |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:常温下,某0.01mol?L-1一元酸HX的电离常数K=1.0×10-6,测得其pH=4,该溶液中c(H+)=10-4 mol/L<0.01mol/L,所以HX为弱酸,
A.电离平衡常数K=
=1.0×10-6,c(H+)=10-4 mol/L,据此计算
;
B.等物质的量的HX和氨水混合,二者恰好反应生成NH4X,根据铵根离子和酸根离子水解程度大小确定溶液酸碱性;
C.NaOH是强电解质、HX是弱电解质,常温下,pH=11的NaOH和pH=3的HX,NaOH浓度小于HX,二者等体积混合,HX有剩余,溶液呈酸性;
D.在HX溶液中滴加烧碱溶液,如果n(NaOH)大于n(HX),可能存在c(Na+)>c(OH-)>c(X-)>c(H+).
A.电离平衡常数K=
| c(H+).c(X-) |
| c(HX) |
| c(X-) |
| c(HX) |
B.等物质的量的HX和氨水混合,二者恰好反应生成NH4X,根据铵根离子和酸根离子水解程度大小确定溶液酸碱性;
C.NaOH是强电解质、HX是弱电解质,常温下,pH=11的NaOH和pH=3的HX,NaOH浓度小于HX,二者等体积混合,HX有剩余,溶液呈酸性;
D.在HX溶液中滴加烧碱溶液,如果n(NaOH)大于n(HX),可能存在c(Na+)>c(OH-)>c(X-)>c(H+).
解答:
解:常温下,某0.01mol?L-1一元酸HX的电离常数K=1.0×10-6,测得其pH=4,该溶液中c(H+)=10-4 mol/L<0.01mol/L,所以HX为弱酸,
A.电离平衡常数K=
=1.0×10-6,c(H+)=10-4 mol/L,
=
=
=0.01,故A正确;
B.等物质的量的HX和氨水混合,二者恰好反应生成NH4X,根据题给信息无法确定铵根离子和酸根离子水解程度相对大小,所以无法确定溶液酸碱性,故B错误;
C.NaOH是强电解质、HX是弱电解质,常温下,pH=11的NaOH和pH=3的HX,NaOH浓度小于HX,二者等体积混合,HX有剩余,酸的电离程度大于酸根离子水解程度,所以溶液呈酸性,故C正确;
D.在HX溶液中滴加烧碱溶液,如果n(NaOH)大于n(HX),溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒得c(Na+)>c(X-),部分氢氧根离子参加反应,所以可能存在c(Na+)>c(OH-)>c(X-)>c(H+),故D正确;
故选B.
A.电离平衡常数K=
| c(H+).c(X-) |
| c(HX) |
| c(X-) |
| c(HX) |
| K |
| c(H+) |
| 10-6 |
| 10-4 |
B.等物质的量的HX和氨水混合,二者恰好反应生成NH4X,根据题给信息无法确定铵根离子和酸根离子水解程度相对大小,所以无法确定溶液酸碱性,故B错误;
C.NaOH是强电解质、HX是弱电解质,常温下,pH=11的NaOH和pH=3的HX,NaOH浓度小于HX,二者等体积混合,HX有剩余,酸的电离程度大于酸根离子水解程度,所以溶液呈酸性,故C正确;
D.在HX溶液中滴加烧碱溶液,如果n(NaOH)大于n(HX),溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒得c(Na+)>c(X-),部分氢氧根离子参加反应,所以可能存在c(Na+)>c(OH-)>c(X-)>c(H+),故D正确;
故选B.
点评:本题考查弱电解质的电离,正确判断电解质HX的强弱是解本题关键,再结合溶液中的溶质及其性质、守恒思想分析解答即可,题目难度不大.

练习册系列答案
相关题目
下列指定反应的离子方程式正确的是( )
| A、Cu溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O | ||||
| B、向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- | ||||
| C、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ | ||||
D、用CuCl2溶液做导电性实验,灯泡发光:CuCl2
|