题目内容
6.
(1)画出b元素的原子结构示意图
 ,并写出元素b的单质在二氧化碳中燃烧的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
,并写出元素b的单质在二氧化碳中燃烧的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C(2)将a、b、c三种元素的最高价氧化物对应的水化物碱性由强到弱排序:NaOH>Mg(OH)2>Al(OH)3(填写物质化学式)
(3)写出元素c的氧化物与元素a的最高价氧化物对应的水化物反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O
(4)将e、f的最高价氧化物对应的水化物酸性较强的是:HClO4 (填写物质化学式)
(5)写出d元素的氢化物(一个分子共有三个原子)电子式:
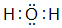 ,写出f元素单质与该氢化物反应的离子方程式:Cl2+H2O=H++Cl-+HClO.
,写出f元素单质与该氢化物反应的离子方程式:Cl2+H2O=H++Cl-+HClO.
分析 由元素在周期表中位置,可知a为Na、b为Mg、c为Al、d为O、e为S、f为Cl.
(1)镁在二氧化碳中燃烧生成氧化镁与碳;
(2)金属性越强,最高价氧化物对应水化物的碱性越强;
(3)元素c的氧化物为Al2O3,元素a的最高价氧化物对应的水化物为NaOH,二者反应生成偏铝酸钠与水;
(4)元素非金属性越强,最高价含氧酸的酸性越强;
(5)d元素的氢化物(一个分子共有三个原子)为H2O,氯气与水反应生成HCl与HClO.
解答 解:由元素在周期表中位置,可知a为Na、b为Mg、c为Al、d为O、e为S、f为Cl.
(1)Mg原子核外电子数为12,原子结构示意图为 ,镁在二氧化碳中燃烧生成氧化镁与碳,化学反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
,镁在二氧化碳中燃烧生成氧化镁与碳,化学反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为: ;2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
;2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(2)金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:NaOH>Mg(OH)2>Al(OH)3,
故答案为:NaOH>Mg(OH)2>Al(OH)3;
(3)元素c的氧化物为Al2O3,元素a的最高价氧化物对应的水化物为NaOH,二者反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)由于非金属性Cl>S,故最高价含氧酸的酸性:HClO4>H2SO4,
故答案为:HClO4;
(5)一个分子共有三个原子的d元素氢化物为H2O,电子式为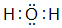 ,氯气与水反应生成HCl与HClO,反应离子方程式为:Cl2+H2O=H++Cl-+HClO,
,氯气与水反应生成HCl与HClO,反应离子方程式为:Cl2+H2O=H++Cl-+HClO,
故答案为: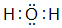 ;Cl2+H2O=H++Cl-+HClO.
;Cl2+H2O=H++Cl-+HClO.
点评 本题以元素周期表为载体,考查学生对元素周期表的掌握、元素周期律、常用化学用语等,关键是熟练掌握短周期元素在周期表中位置,有利于基础知识的巩固.

①电离程度增大 ②$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 ③c(H+) 增大④导电性增强 ⑤$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大.
| A. | 仅①②③ | B. | 仅①③④ | C. | 仅①③⑤ | D. | 仅②③④ |
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
②下列说法正确的是(填字母)ac.
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.若容器内压强恒定时,标志反应达到平衡状态
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.增加Fe2O3可以提高CO2的转化率.
| A. | CO | B. | NH3 | C. | SO2 | D. | HCl |

| A. | M与A均能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | B中含有羧基和羟基两种官能团,B能发生消去反应和酯化反应 | |
| C. | 1molM与热的烧碱溶液反应,可消耗2nmol的NaOH | |
| D. | A、B、C各1mol分别与金属钠反应,放出气体的物质的量之比为1:2:2 |
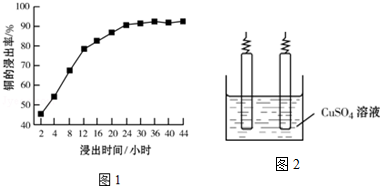
 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.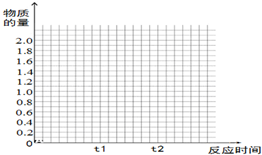 将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题: