题目内容
8.下列氧化还原反应中,水只作为还原剂的是( )| A. | 3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
分析 有元素化合价变化的反应为氧化还原反应,水中只有O元素的化合价升高时水只作为还原剂,以此来解答.
解答 解:A.3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2中,属于氧化还原反应,水中H元素的化合价降低,水作氧化剂,故A错误;
B.2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,水中H、O元素的化合价都发生变化,则水既是氧化剂又是还原剂,故B错误;
C.2Na2O2+2H2O═4NaOH+O2↑中,Na2O2中O元素的化合价既升高又降低,属于氧化还原反应,水中H、O元素的化合价都没有变化时水既不做氧化剂又不做还原剂,故C错误;
D.2F2+2H2O═4HF+O2,该反应中水中只有O元素的化合价升高时水只作为还原剂,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及氧化还原反应基本概念为解答的关键,侧重氧化剂、还原剂判断的考查,题目难度不大.

练习册系列答案
相关题目
19.在20℃时,在一刚性容器内部有一个不漏气且可滑动的活塞将容器分隔成左右两室.左室充入氮气,右室充入氢气与氧气的混合气体,活塞恰好停留在离左端的$\frac{1}{4}$处(如图左所示),然后引燃氢、氧混合气体,反应完毕后恢复至原来温度,活塞恰好停在中间(如图所示),如果忽略水蒸气体积,则反应前氢气与氧气的体积比可能是( )
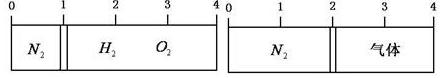

| A. | 3:4 | B. | 4:5 | C. | 6:2 | D. | 2:7 |
16.有pH均为2的a盐酸、b醋酸两瓶溶液,与足量锌反应放出等体积H2所需时间的长短顺序是a>b(用“>”、“<”、“=”表示,下同);完全中和等物质的量的NaOH溶液需两种酸的体积大小顺序是a>b.
3.关于物质的用途说法错误的是( )
| A. | 工业上以硫为原料制硫酸 | B. | 二氧化硅用于制造光导纤维 | ||
| C. | 铁在商代用于铸造司母戊鼎 | D. | 铝合金用于制造门窗 |
13.下列变化不是由加成反应引起的是( )
| A. | 苯中加溴水振荡,溴水层褪色 | |
| B. | 乙烯通入溴水,溴水褪色 | |
| C. | 石油裂解后的气体通入溴水,溴水褪色 | |
| D. | 苯转化为环己烷 |
20.下列有关说法正确的是( )
| A. | 伴有能量变化的物质变化都是化学变化 | |
| B. | 催化剂可以改变化学反应速率但不能改变化学反应的反应热 | |
| C. | 室温下,100mLpH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HA酸性比HB弱 | |
| D. | 对于反应2SO2(g)+O2(g)?2SO3(g)△H<0,压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
17.生活中处处有化学,请你根据所学知识,判断下列说法错误的是( )
| A. | 为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒 | |
| B. | 医疗上常用高温煮蒸的方法对医疗器械进行消毒 | |
| C. | 生活中常用在豆浆中加入少量石膏的方法来使豆浆凝固制作豆腐 | |
| D. | 对环境进行消毒的原理是使细菌变性,可以用浓HNO3代替“84”消毒液 |
18.NaCl是一种化工原料,可以制备一系列物质(如图)
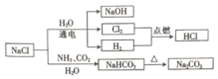
已知:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
下列说法正确的是( )

已知:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
下列说法正确的是( )
| A. | NaHCO3的热稳定性较好 | |
| B. | H2与Cl2反应时产生苍白色火焰 | |
| C. | NaOH俗称纯碱 | |
| D. | 图中所示转化反应都是氧化还原反应 |
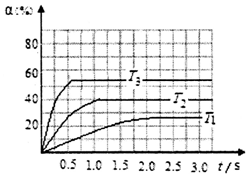 硫及其化合物是重要的化工原料,在工农业生产应用广泛.
硫及其化合物是重要的化工原料,在工农业生产应用广泛.