题目内容
16.有pH均为2的a盐酸、b醋酸两瓶溶液,与足量锌反应放出等体积H2所需时间的长短顺序是a>b(用“>”、“<”、“=”表示,下同);完全中和等物质的量的NaOH溶液需两种酸的体积大小顺序是a>b.分析 醋酸为弱酸,pH相等时醋酸的浓度较大,则生成等量氢气时醋酸反应速率加快,消耗时间较短;醋酸浓度较大,则中和等物质的量的NaOH溶液时消耗盐酸体积较大,据此进行解答.
解答 解:pH均为2的a盐酸、b醋酸两瓶溶液,由于醋酸为弱酸,pH相等时醋酸的浓度较大,与锌反应的过程中醋酸的平均反应速率较大,则与足量锌反应放出等体积H2所需时间的长短顺序是a>b;
由于醋酸浓度较大,则完全中和等物质的量的NaOH溶液消耗盐酸体积较大,即需两种酸的体积大小顺序是:a>b,
故答案为:>;>.
点评 本题考查了pH计算、反应速率的影响等知识,明确弱电解质的电离特点为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的灵活应用能力.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
13.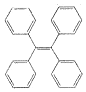 TPE及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛.TPE的结构简式如图,下列关于TPE的说法正确的是( )
TPE及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛.TPE的结构简式如图,下列关于TPE的说法正确的是( )
 TPE及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛.TPE的结构简式如图,下列关于TPE的说法正确的是( )
TPE及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛.TPE的结构简式如图,下列关于TPE的说法正确的是( )| A. | TPE属于苯的同系物 | |
| B. | TPE能发生加成反应,但不能取代反应 | |
| C. | TPE与化合物 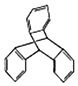 互为同分异构体 互为同分异构体 | |
| D. | TPE的一氯代物有3种 |
7.有一未知浓度的硫酸溶液50mL,在加入0.5mol/L Ba(NO3)2溶液25mL后,改加NaOH溶液,结果用去1.0mol/L NaOH溶液50mL恰好完全中和,则硫酸的物质的量浓度是( )
| A. | 0.5 mol/L | B. | 1.0 mol/L | C. | 1.5 mol/L | D. | 2.0 mol/L |
4.用作麻醉剂的氯仿(CHCl3)常因保存不慎而被空气氧化,产生剧毒的光气(COCl2),反应的化学方程式为2CHCl3+O2═2HCl+2COCl2.为了防止事故,使用前可用于检验氯仿是否变质的试剂是(注:CHCl3不与AgNO3溶液反应产生沉淀)( )
| A. | 酚酞试液 | B. | 用石蕊溶液 | ||
| C. | NaOH溶液 | D. | 用硝酸酸化后的AgNO3溶液 |
11.下列物质中,不能使酸性高锰酸钾溶液褪色的是( )
| A. | 苯乙烯 | B. | 乙烯 | C. | 乙醇 | D. | 聚乙烯 |
8.下列氧化还原反应中,水只作为还原剂的是( )
| A. | 3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
5.常温下,下列说法正确的是( )
| A. | 0.1mol•L-1的氯化铵溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| B. | 0.1mol•L-1的硫化钠溶液中:c(Na+)=2c(S2-)+c(HS-)+c(H2S) | |
| C. | 在NaHCO3溶液中加入与其等物质的量的NaOH后:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 物质的量浓度相等的CH3COOH和NaOH溶液等体积混合后:c(CH3COOH)+c(H+)=c(OH-) |
6.化学在生活中有着广泛的应用,下列物质性质与应用对应关系错误的是( )
| A. | 硅胶吸水能力强,可作食品干燥剂 | |
| B. | CaO能与SO2反应,可作工业废气脱硫剂 | |
| C. | NaClO具有强氧化性,可作织物漂白剂 | |
| D. | Na2S具有还原性,可作废水中Cu2+和Hg2+的沉淀剂 |