题目内容
5. 硫及其化合物是重要的化工原料,在工农业生产应用广泛.
硫及其化合物是重要的化工原料,在工农业生产应用广泛.(1)二氯亚砜(SOCl2)在有机合成工业用做氯化剂和脱水剂,遇水能产生白雾,并有刺激性气味的气体生成.SOCl2中硫的化合价为+4,与水反应的化学方程式为SOCl2+H2O=SO2+2HCl.
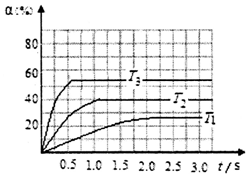
(2)H2S气体有剧毒,高温下能够发生反应H2S(g)?H2(g)+$\frac{1}{2}$S2(g)△H.在2L的密闭容器中加入0.1mol的H2S,测得不同温度下(T)H2S的转化率α随时间(t)的变化关系如右图所示.T2温度时反应的平衡常数K=0.067;该反应的△H>0(填“>”或“<”);其判断理由是温度越高达平衡时间越短,反应速率越快,对应的温度越高,所以温度的大小为:T3>T2>T1,而图中可知升高温度平衡转化率增大,反应向正反应方向进行,所以正反应是吸热反应.
(3)已知Na2SO3+S$\frac{\underline{\;\;△\;\;}}{\;}$ Na2S2O3.实验室中将SO2缓缓通入一定比例的Na2S和Na2CO3的热溶液中可制得Na2S2O3,理论上Na2S和Na2CO3的最佳物质的量之比为2:1;反应过程中产生气体的主要成分是二氧化碳,其作用是二氧化碳气体排除空气中的氧气,防止氧化Na2S2O3和Na2SO3.
(4)在水产养殖中可用Na2S2O3将水中残余的微量Cl2除去.在某鱼塘中取水样10.00mL,用0.000l mol•L-1NaOH标准溶液滴定(假设其他成分不与NaOH反应),滴定终点时消耗NaOH溶液20.00mL.若鱼塘贮水1×105m3,则消除该鱼塘中的氯气需投入Na2S2O3的质量为395kg.
分析 (1)根据化合价代数和为0分析解答,SOCl2中二氯亚砜(SOCl2)在有机合成工业用做氯化剂和脱水剂,遇水能产生白雾是氯化氢,并有刺激性气味的气体是二氧化硫气体,由此书写化学方程式;
(2)由图可知T2温度时H2S的转化率40%,根据三行式分析解答;由图可知T3首先达平衡状态,T1最后达平衡状态,达平衡时间越短,反应速率越快,对应的温度越高;
(3)SO2缓缓通入一定比例的Na2S和Na2CO3的热溶液中可制得Na2S2O3,反应的化学方程式为:4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2,由此分析解答;
(4)根据电子得失守恒得关系式$\frac{1}{4}$Na2S2O3~~Cl2~~2NaOH进行计算;
解答 解:(1)SOCl2中氧元素是-2价,氯元素是-1价,根据化合价代数和为0,所以硫元素为+4价,SOCl2中二氯亚砜(SOCl2)在有机合成工业用做氯化剂和脱水剂,遇水能产生白雾是氯化氢,并有刺激性气味的气体是二氧化硫气体,化学方程式为:SOCl2+H2O=SO2+2HCl,故答案为:+4;SOCl2+H2O=SO2+2HCl;
(2)由图可知T2温度时H2S的转化率40%,
反应 H2S(g)?H2(g)+$\frac{1}{2}$S2(g)△
c(初):0.05 0 0
c(变):0.02 0.02 0.01
c(平):0.03 0.02 0.01
K=$\frac{0.02×\sqrt{0.01}}{0.03}$=0.067,由图可知T3首先达平衡状态,T1最后达平衡状态,达平衡时间越短,反应速率越快,对应的温度越高,所以温度的大小为:T3>T2>T1,而图中可知升高温度平衡转化率增大,反应向正反应方向进行,所以正反应是吸热反应,故答案为:0.067;>;温度越高达平衡时间越短,反应速率越快,对应的温度越高,所以温度的大小为:T3>T2>T1,而图中可知升高温度平衡转化率增大,反应向正反应方向进行,所以正反应是吸热反应;
(3)SO2缓缓通入一定比例的Na2S和Na2CO3的热溶液中可制得Na2S2O3,反应的化学方程式为:4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2,所以理论上Na2S和Na2CO3的最佳物质的量之比为2:1,生成的气体为二氧化碳,二氧化碳气体排除空气中的氧气,防止氧化Na2S2O3和Na2SO3,故答案为:2:1;二氧化碳;二氧化碳气体排除空气中的氧气,防止氧化Na2S2O3和Na2SO3;
(4)根据关系式$\frac{1}{4}$Na2S2O3~~Cl2~~~~~2NaOH
$\frac{1}{4}$×158g 2mol
m(Na2S2O3) 0.02×0.000lmol
解之得:m(Na2S2O3)=3.95×10-5g,所以鱼塘贮水1×105m3,消除该鱼塘中的氯气需投入Na2S2O3的质量为$\frac{1{0}^{5}×1{0}^{6}}{10}$×3.95×10-5g=395kg,故答案为:395.
点评 本题考查氯气的性质及氧化还原反应相关计算,为高频考点,把握化学反应原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.


| 溶液 | 加入物质 | 对应的图象 |
| (1)饱和石灰水 | 通过量CO2气体 | |
| (2)氯化铝溶液 | 加入过量氨水 | |
| (3)MgCl2、AICl3的混合液 | 逐滴加入NaOH溶液至过量 | |
| (4)含少量NaOH的NaAlO2溶液 | 逐滴加入稀盐酸 |
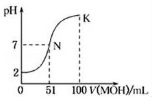 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是( )| A. | HA为一元强酸,MOH为一元弱碱 | |
| B. | N点溶液中离子浓度大小关系为:c(M+)=c(A-)>c(H+)=c(OH-) | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | N→k之间曲线上任意一点都有c(M+)>c(OH-)>c(A-)>c(H+) |
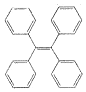 TPE及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛.TPE的结构简式如图,下列关于TPE的说法正确的是( )
TPE及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛.TPE的结构简式如图,下列关于TPE的说法正确的是( )| A. | TPE属于苯的同系物 | |
| B. | TPE能发生加成反应,但不能取代反应 | |
| C. | TPE与化合物 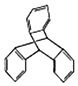 互为同分异构体 互为同分异构体 | |
| D. | TPE的一氯代物有3种 |
| 实验内容 | 实验现象 | 相关解释 | |
| A | 等量的Cu分别与等体积足量的浓硝酸和稀硝酸反应 | 浓硝酸反应后呈绿色,稀硝酸反应后呈蓝色 | c(Cu2+)不同 |
| B | NH3与Cl2混合 | 生成白烟 | NH3与Cl2发生化合反应生成NH4Cl |
| C | 往Fe(OH)3胶体中逐滴滴入稀盐酸 | 先出现红褐色沉淀,后沉淀溶解 | 先胶体聚沉,后Fe(OH)3溶解 |
| D | 加热硝酸铜固体,将带火星的木条伸入所得的气体中 | 生成红棕色气体,带火星木条复燃 | 2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑有氧气生成,不能说明NO2有助燃性. |
| A. | A | B. | B | C. | C | D. | D |
| A. | 形成简单离子的离子半径为D>C>A | |
| B. | 四种元素形成的简单氢化物中,D的沸点最高 | |
| C. | B的氧化物对应水化物为弱酸,C和D的氧化物对应水化物均为强酸 | |
| D. | C和D形成的某种化合物具有8电子稳定结构,其化学式可能是C2D2 |
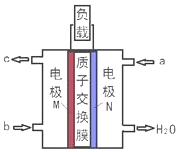 甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用.某型甲醇燃料电池的总反应式2CH4O+3O2═2CO2+4H2O,下图是该燃料电池的示意图.下列说法正确的是( )
甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用.某型甲醇燃料电池的总反应式2CH4O+3O2═2CO2+4H2O,下图是该燃料电池的示意图.下列说法正确的是( )| A. | a是甲醇燃料、b是氧气 | |
| B. | 当转移6mol e-时,消耗33.6L O2 | |
| C. | 负极反应:CH4O-6e-+H2O═CO2↑+6H+ | |
| D. | 质子从N电极区穿过交换膜移向M电极区 |
| A. | 0.5 mol/L | B. | 1.0 mol/L | C. | 1.5 mol/L | D. | 2.0 mol/L |
| A. | 3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |