题目内容
18.NaCl是一种化工原料,可以制备一系列物质(如图)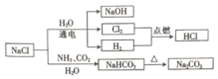
已知:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
下列说法正确的是( )
| A. | NaHCO3的热稳定性较好 | |
| B. | H2与Cl2反应时产生苍白色火焰 | |
| C. | NaOH俗称纯碱 | |
| D. | 图中所示转化反应都是氧化还原反应 |
分析 A、碳酸氢钠不稳定,受热分解生成碳酸钠、二氧化碳和水;
B、氢气与氯气反应时产生苍白色火焰生成HCl;
C、氢氧化钠的俗名是烧碱;
D、根据元素的化合价是否变化判断.
解答 解:A、由转化可知,氯化钠溶液与氨气、二氧化碳反应析出碳酸氢钠,则25℃时,NaHCO3在水中的溶解度比Na2CO3的小,故A错误;
B、氢气与氯气反应时产生苍白色火焰生成HCl,HCl挥发到空气中形成盐酸小液滴形成白雾,故B正确;
C、氢氧化钠的俗名是烧碱,纯碱是碳酸钠的俗名,故C错误;
D、氯化钠和水、氨气、二氧化碳的反应以及碳酸氢钠的分解反应都不是氧化还原反应,故D错误;
故选B.
点评 本题考查了盐的稳定性、氧化还原反应等问题,是小型综合题;氧化还原反应根据化合价的变化判断即可.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
8.下列氧化还原反应中,水只作为还原剂的是( )
| A. | 3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
9.下列化学用语正确的是( )
| A. | 乙酸根离子的结构式: | B. | 醛基的电子式: | ||
| C. | 乙酸的结构简式C2H4O2 | D. | 聚乙烯的最简式为CH2 |
6.化学在生活中有着广泛的应用,下列物质性质与应用对应关系错误的是( )
| A. | 硅胶吸水能力强,可作食品干燥剂 | |
| B. | CaO能与SO2反应,可作工业废气脱硫剂 | |
| C. | NaClO具有强氧化性,可作织物漂白剂 | |
| D. | Na2S具有还原性,可作废水中Cu2+和Hg2+的沉淀剂 |
13.在某澄清透明的酸性溶液中能大量共存的离子组是( )
| A. | Mg2+、Ca2+、CO32-、NO3- | B. | Ba2+、Na+、Cl-、OH- | ||
| C. | Cu2+、Fe2+、Cl-、SO42- | D. | NH4+、CO32-、K+、S2- |
3.某化学研究性学习小组模拟工业生产流程制备无水氯化铁并对产物做如下探究实验.
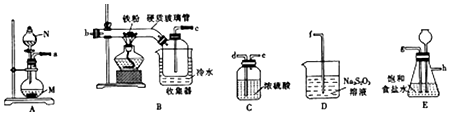
已知:①无水氯化铁在空气中易潮解,加热易升华;
②工业上,向500~600℃的铁屑中通人氯气可生产无水氯化铁;
③向炽热的铁屑中通入氯化氢可以生产无水氯化亚铁和氢气,
(1)仪器N的名称是分液漏斗,N中盛有浓盐酸,烧瓶M中的固体试剂KMnO4(或KClO3) (填化学式).
(2)装置的连接顺序为→a,→g→h→d→e→bc→d→e→f.(用小写字母表示,部分装置可以重复使用)
(3)若缺少装置E,则对本实验造成的影响是HCl和Fe反应生成的H2与Cl2混合受热发生爆炸,且有杂质氯化亚铁生成
(4)已知硫代硫酸钠(Na2S2O3)溶液在工业上可作脱氯剂,反应后Na2S2O3被氧化为Na2SO4,则装置D中
发生反应的离子方称式为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+.
(5)实验结束并冷却后,将硬质玻璃管及收集器中的物质 一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
固体混合物$\stackrel{过量稀盐酸}{→}$淡黄色溶液$\stackrel{KSCN溶液}{→}$淡红色溶液$\stackrel{过量H_{2}O_{2}溶液}{→}$深红色溶液$\stackrel{静置一段溶液}{→}$红色褪去
①淡红色溶液中加入过量H2O2溶液后,溶液红色加深的原因是2Fe2++2H++H2O2=2F3++2H2O(用离子方程式表示).
②已知红色褪去的同时有气体生成,经检验气体为O2.该小组对红色褪去的原因进行探究.
由实验Ⅰ和Ⅱ可得出的结论为H2O2将SCN-氧化成SO42-.

已知:①无水氯化铁在空气中易潮解,加热易升华;
②工业上,向500~600℃的铁屑中通人氯气可生产无水氯化铁;
③向炽热的铁屑中通入氯化氢可以生产无水氯化亚铁和氢气,
(1)仪器N的名称是分液漏斗,N中盛有浓盐酸,烧瓶M中的固体试剂KMnO4(或KClO3) (填化学式).
(2)装置的连接顺序为→a,→g→h→d→e→bc→d→e→f.(用小写字母表示,部分装置可以重复使用)
(3)若缺少装置E,则对本实验造成的影响是HCl和Fe反应生成的H2与Cl2混合受热发生爆炸,且有杂质氯化亚铁生成
(4)已知硫代硫酸钠(Na2S2O3)溶液在工业上可作脱氯剂,反应后Na2S2O3被氧化为Na2SO4,则装置D中
发生反应的离子方称式为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+.
(5)实验结束并冷却后,将硬质玻璃管及收集器中的物质 一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
固体混合物$\stackrel{过量稀盐酸}{→}$淡黄色溶液$\stackrel{KSCN溶液}{→}$淡红色溶液$\stackrel{过量H_{2}O_{2}溶液}{→}$深红色溶液$\stackrel{静置一段溶液}{→}$红色褪去
①淡红色溶液中加入过量H2O2溶液后,溶液红色加深的原因是2Fe2++2H++H2O2=2F3++2H2O(用离子方程式表示).
②已知红色褪去的同时有气体生成,经检验气体为O2.该小组对红色褪去的原因进行探究.
| 实验 | 操作 | 现象 | |
| 实验I(取褪色后溶液3等份) | 第1份 | 滴加FeCl3溶液 | 无明显变化 |
| 第2份 | 滴加KSCN溶液 | 溶液出现红色 | |
| 第3份 | 滴加稀盐酸和BaCl2 | 产生白色沉淀 | |
| 实验Ⅱ(取褪色后溶液同浓度的FeCi3溶液) | 滴加2KSCN溶液,溶液变红,再通入O2 | 无明显变化 | |
10.下列物质属于酸性氧化物的是( )
| A. | Na2O2 | B. | CO | C. | CaO | D. | SiO2 |
11.下列实验操作不能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 除去蛋白质中混有的(NH4)2SO4 | 将混合物装入半透明袋,并放入流动的蒸馏水中 |
| B | 除去Mg粉中混有Al粉 | 加入足量NaOH溶液,过滤、洗涤、干燥 |
| C | 用苯萃取溴水中的Br2 | 先从分液漏斗下口放出水层,再从上口倒出有机层 |
| D | 测定NaClO溶液中的pH | 用玻璃棒蘸取溶液点滴在pH试纸上,与标准比色卡对照 |
| A. | A | B. | B | C. | C | D. | D |
 .
.