题目内容
19.在20℃时,在一刚性容器内部有一个不漏气且可滑动的活塞将容器分隔成左右两室.左室充入氮气,右室充入氢气与氧气的混合气体,活塞恰好停留在离左端的$\frac{1}{4}$处(如图左所示),然后引燃氢、氧混合气体,反应完毕后恢复至原来温度,活塞恰好停在中间(如图所示),如果忽略水蒸气体积,则反应前氢气与氧气的体积比可能是( )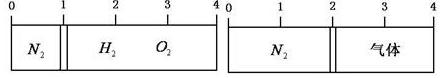
| A. | 3:4 | B. | 4:5 | C. | 6:2 | D. | 2:7 |
分析 温度、压强相等,二者的体积之比等于物质的量之比;反应后恢复至原来的温度,活塞恰好停在中间(图b),说明反应后氮气和剩余气体的物质的量相等,据此分析解答.
解答 解:温度、压强相等,二者的体积之比等于物质的量之比,活塞恰好停留在离左端的$\frac{1}{4}$ 处(如图左所示),
假设氮气的物质的量为1mol,则氢气和氧气的物质的量之和为3mol;
反应后恢复至原来的温度,活塞恰好停在中间(如图右所示),说明反应后氮气和剩余气体的物质的量相等,所以剩余气体的物质的量为1mol,
2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,
假设氢气完全反应,根据方程式知,氢气物质的量为:$\frac{3mol-1mol}{3}$×2=$\frac{4}{3}$mol,则氧气物质的量为:$\frac{5}{3}$mol,相同条件下,气体的体积之比等于物质的量之比,所以氢气和氧气体积之比=$\frac{4}{3}$mol:$\frac{5}{3}$mol=4:5;
假设氧气完全反应,根据方程式知,氧气的物质的量为:$\frac{3mol-1mol}{3}$=$\frac{2}{3}$mol,氢气的物质的量为:3mol-$\frac{2}{3}$mol=$\frac{7}{3}$mol,
相同条件下,气体的体积之比等于物质的量之比,所以氢气和氧气的体积之比=$\frac{7}{3}$mol:$\frac{2}{3}$mol=7:2,
故选B.
点评 本题考查阿伏伽德罗定律及其推论,明确相同条件下气体体积与物质的量的关系是解本题关键,注意平衡状态下左右两室的压强相等,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.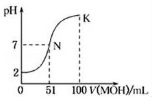 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是( )
 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是( )| A. | HA为一元强酸,MOH为一元弱碱 | |
| B. | N点溶液中离子浓度大小关系为:c(M+)=c(A-)>c(H+)=c(OH-) | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | N→k之间曲线上任意一点都有c(M+)>c(OH-)>c(A-)>c(H+) |
17.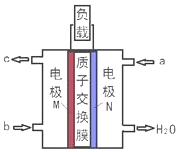 甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用.某型甲醇燃料电池的总反应式2CH4O+3O2═2CO2+4H2O,下图是该燃料电池的示意图.下列说法正确的是( )
甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用.某型甲醇燃料电池的总反应式2CH4O+3O2═2CO2+4H2O,下图是该燃料电池的示意图.下列说法正确的是( )
 甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用.某型甲醇燃料电池的总反应式2CH4O+3O2═2CO2+4H2O,下图是该燃料电池的示意图.下列说法正确的是( )
甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用.某型甲醇燃料电池的总反应式2CH4O+3O2═2CO2+4H2O,下图是该燃料电池的示意图.下列说法正确的是( )| A. | a是甲醇燃料、b是氧气 | |
| B. | 当转移6mol e-时,消耗33.6L O2 | |
| C. | 负极反应:CH4O-6e-+H2O═CO2↑+6H+ | |
| D. | 质子从N电极区穿过交换膜移向M电极区 |
7.有一未知浓度的硫酸溶液50mL,在加入0.5mol/L Ba(NO3)2溶液25mL后,改加NaOH溶液,结果用去1.0mol/L NaOH溶液50mL恰好完全中和,则硫酸的物质的量浓度是( )
| A. | 0.5 mol/L | B. | 1.0 mol/L | C. | 1.5 mol/L | D. | 2.0 mol/L |
14.下列说法正确的是( )
| A. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| B. | 100℃时,纯水中c(H +)=1×10-6 mol•L-1,此时纯水显酸性 | |
| C. | 等体积pH=12 NaOH溶液和pH=2 CH3COOH溶液混合,混合后溶液pH>7 | |
| D. | 1mol/L醋酸溶液加水稀释,溶液中所有离子浓度均减小 |
4.用作麻醉剂的氯仿(CHCl3)常因保存不慎而被空气氧化,产生剧毒的光气(COCl2),反应的化学方程式为2CHCl3+O2═2HCl+2COCl2.为了防止事故,使用前可用于检验氯仿是否变质的试剂是(注:CHCl3不与AgNO3溶液反应产生沉淀)( )
| A. | 酚酞试液 | B. | 用石蕊溶液 | ||
| C. | NaOH溶液 | D. | 用硝酸酸化后的AgNO3溶液 |
11.下列物质中,不能使酸性高锰酸钾溶液褪色的是( )
| A. | 苯乙烯 | B. | 乙烯 | C. | 乙醇 | D. | 聚乙烯 |
8.下列氧化还原反应中,水只作为还原剂的是( )
| A. | 3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
9.下列化学用语正确的是( )
| A. | 乙酸根离子的结构式: | B. | 醛基的电子式: | ||
| C. | 乙酸的结构简式C2H4O2 | D. | 聚乙烯的最简式为CH2 |