题目内容
7.100mL 2mol•L-1的盐酸分别与0.5mol Na、Mg、Al充分反应,相同条件下产生H2的量( )| A. | Na多 | B. | Mg多 | C. | Al多 | D. | 一样 |
分析 根据三种金属与盐酸反应的方程式结合物质的过量和不足进行计算,得到氢气的量按照物质的量少的进行计算,注意金属钠会和水反应生成氢气.
解答 解:Na、Mg、Al与盐酸反应生成H2,由关系式:2Na~2HCl~H2,2Na~2H2O~H2,Mg~2HCl~H2,$\frac{2}{3}$Al~2HCl~H2,0.5molNa与100ml、2mol•L-1的稀盐酸充分反应,共生成氢气0.25mol,0.5molMg和100ml、2mol•L-1的稀盐酸充分反应,金属镁会剩余,生成氢气的物质的量是0.1mol,0.5molAl和100ml、2mol•L-1的稀盐酸充分反应,金属铝会剩余,生成氢气0.1mol,所以相同条件下产生H2的量钠最多,故选A.
点评 本题考查化学方程式的计算,题目难度不大,注意根据化学方程式判断有关反应的量的关系.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
4.已知反应2SO2(g)+O2(g)?2SO3(g)△H<0.下列有关该反应的图象及叙述正确的是( )
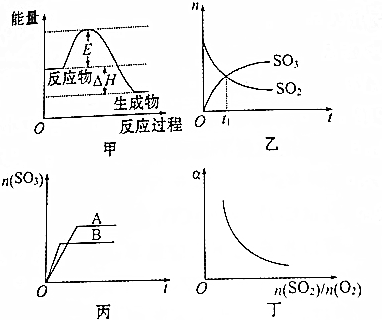

| A. | 加入适当的催化剂后,甲图中的E和△H都减小 | |
| B. | 乙图中t1时刻反应达到化学平衡状态 | |
| C. | 丙图可以表示其他条件不变时,压强对反应的影响 | |
| D. | 丁图中a可以表示SO2的转化率 |
5.在强酸性溶液中,可以大量共存的离子是( )
| A. | Na+、K+、SO42-、CO32- | B. | NH4+、Mg2+、SO42-、Cl- | ||
| C. | Na+、K+、HCO3-、Cl- | D. | Na+、K+、AlO2-、NO3- |
15.下列的分离方法正确的是( )
| A. | 除去 KCl中的K2CO3可先加入过量的BaCl2溶液,待沉淀完全后再过滤、洗涤,取滤液蒸发即得纯净的KCl | |
| B. | 氯化钠的溶解度随着温度下降而减少,用冷却结晶法从热的含有少量氯化钾浓溶液中可得到纯净的氯化钠 | |
| C. | 除去Cu粉中混有的少量Fe粉可加入过量的稀盐酸,待无气泡产生后过滤烘干即可 | |
| D. | 通过点燃可除去二氧化碳中混有的CO气体 |
12.硅及其化合物是重要的无机材料,其中光导纤维的成份是( )
| A. | 硅 | B. | 二氧化硅 | C. | 硅酸钠 | D. | 硅酸 |
19.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| B. | 2L 0.5 mol•L-1 亚硫酸溶液中含有的H+数为2NA | |
| C. | 分子总数为NA的SO2和CO2混合气体中含有的氧原子数为2NA | |
| D. | 1mol FeI2与足量氯气反应时转移的电子数为2NA |
17.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 16g氧气所含的氧原子数为2NA | |
| B. | 18g水所含的电子数为NA | |
| C. | 2.4g金属镁与盐酸(足量)反应失去的电子数为0.1NA | |
| D. | 17g氨气所含电子数目为10NA |
 前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题: .
.