题目内容
5.在强酸性溶液中,可以大量共存的离子是( )| A. | Na+、K+、SO42-、CO32- | B. | NH4+、Mg2+、SO42-、Cl- | ||
| C. | Na+、K+、HCO3-、Cl- | D. | Na+、K+、AlO2-、NO3- |
分析 强酸性溶液中含有大量H+,离子之间不反应且和H+不反应的能大量共存,据此分析解答.
解答 解:A.H+、CO32-发生复分解反应生成二氧化碳和水,所以不能大量共存,故A错误;
B.这几种离子之间不反应且和H+不反应,所以能大量共存,故B正确;
C.H+、HCO3-发生复分解反应生成二氧化碳和水,所以不能大量共存,故C错误;
D.H+、AlO2-发生复分解反应而不能大量共存,故D错误;
故选B.
点评 本题考查离子共存,为高频考点,明确离子性质及离子共存条件是解本题关键,侧重考查复分解反应,注意隐含条件“强酸性溶液”,题目难度不大.

练习册系列答案
相关题目
15.已知常温下测得浓度均为0.1mol•L-1的下列6中溶液的pH:
请根据上述信息判断下列反应不能发生的是( )
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.1 | 11.6 | 10.3 | 11.1 | 11.3 |
| A. | CO2+H2O+2NaClO═Na2CO3+2HClO | B. | CO2+H2O+NaClO═NaHCO3+HClO | ||
| C. | CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH | D. | CH3COOH+NaCN═CH3COONa+HCN |
16.海洋是地球生命的摇篮,她为地球生命提供了水循环,为地球储存能量,吸收、分解地球生命排出的各种物质,使地球适合生命的存在,下列说法中不正确的是( )
| A. | 海水蒸发→云→降水,这是地球水循环的过程,该过程主要是物理变化 | |
| B. | 海水中所含的常量元素大部分以盐的形式存在,其中含量最高的盐是氯化钠 | |
| C. | 海洋是化学元素的集散地,元素周期表所有的元素在海水中都能找到 | |
| D. | 由海水制备镁、氯、溴、碘等单质均需要涉及氧化还原反应 |
20.W、X、Y、Z为原子序数依次增大的短周期元素,W原子与X原子最外层电子数之和与Z原子最外层电子数相等.Z原子最外层电子数是Y原子最外层电子数的2倍,XW3气体能使酚酞溶液变红.下列说怯正确的是( )
| A. | 单质沸点:X>Y | B. | 阳离子的氧化性:W>Y | ||
| C. | 氧化物对应水化物的酸性:Z>X | D. | Y、Z离子均能抑制水的电离 |
3.1996年2月,德国达姆斯特重离子研究所合成出当时最重要的人造元素,它是由${\;}_{30}^{70}$Zn撞入一个${\;}_{82}^{208}$Pb的原子核,并立即释放出一个中子而产生的一种新元素的原子.该元素的原子核内所含有的质子数是( )
| A. | 111 | B. | 112 | C. | 113 | D. | 114 |
7.100mL 2mol•L-1的盐酸分别与0.5mol Na、Mg、Al充分反应,相同条件下产生H2的量( )
| A. | Na多 | B. | Mg多 | C. | Al多 | D. | 一样 |
8.把一小粒金属钠放入足量的硫酸铜溶液中.下列物质中属于该反应最终产物的是( )
| A. | Cu | B. | Cu(OH)2 | C. | CuO | D. | NaOH |
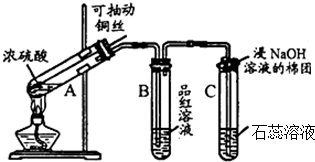
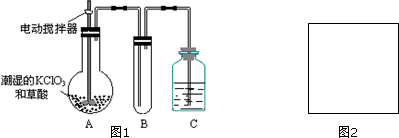 X+5H2O,则X的化学式NaCl.
X+5H2O,则X的化学式NaCl.