题目内容
16. 前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:(1)D2+的价层电子排布图为
 .
.(2)A、B和D三种元素组成的一个化合物的晶胞如图所示.
①该化合物的化学式为K2NiF4;D的配位数为6;
②列式计算该晶体的密度3.4g•cm-3.
(3)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有离子键和配位键;该化合物中存在一个复杂离子,该离子的化学式为[FeF6]3-,配位体是F-.
分析 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有一个,并且A-和B+的电子数相差为8,A属于第VIIA族元素,B属于第IA族元素,且A的原子序数小于B,则A是F元素,B是K元素;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,且C和D的原子序数大于B,C的原子序数小于D,则C是Fe元素,D是Ni元素,结合物质结构和性质解答.
解答 解:前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有一个,并且A-和B+的电子数相差为8,A属于第VIIA族元素,B属于第IA族元素,且A的原子序数小于B,则A是F元素,B是K元素;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,且C和D的原子序数大于B,C的原子序数小于D,则C是Fe元素,D是Ni元素,
(1)D2+的价层电子为3d电子,根据能量最低原理、保里不相容原理及洪特规则知,其价电子排布图为 ,
,
故答案为: ;
;
(2)①该晶胞中A原子个数=16×$\frac{1}{4}$+$4×\frac{1}{2}$+2=8,B原子个数=8×$\frac{1}{4}$=4,D原子个数=8×$\frac{1}{8}$,所以该化合物的化学式为K2NiF4,根据晶胞结构知,D的配位数是6,
故答案为:K2NiF4;6;
②该晶胞的体积=(400×10-10cm)2×(1308×10-10cm),ρ=$\frac{m}{V}$=$\frac{\frac{39×4+59×2+19×8}{N{\;}_{A}}}{40{0}^{2}×1308×1{0}^{-30}}$g•cm-3=3.4g•cm-3,
故答案为:3.4;
(3)A-、B+和C3+三种离子组成的化合物的K3FeF6,该物质中阴阳离子间存在离子键,铁原子和氟原子间存在配位键,该化合物中存在一个复杂离子,该离子的化学式为[FeF6]3-,配位体是F-,
故答案为:离子键和配位键;[FeF6]3-;F-.
点评 本题考查物质结构和性质,正确推断元素是解本题关键,难度中等,注意化学式的确定中,各中原子被几个晶胞共用,为易错点,难点是密度的计算.

| A. | Na多 | B. | Mg多 | C. | Al多 | D. | 一样 |
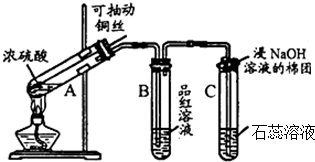
| A. | 保存FeCl2溶液时,通常在溶液中加少量的单质铁 | |
| B. | 常温下,浓硝酸可以用铁罐车贮运 | |
| C. | 可用湿润的蓝色石蕊试纸检验氨气 | |
| D. | 除去CO2中混有的HCl,可通过盛有饱和NaHCO3溶液的洗瓶 |
| A. | 相同物质的量浓度的下列溶液中NH4+的浓度:(NH4)2SO4>NH4Cl>NH4HCO3 | |
| B. | 微粒半径:K+>S2->F- | |
| C. | 给出质子的能力:CH3COOH>C2H5OH>H2O | |
| D. | 氢化物的沸点:HF>HCl>HBr |
| A. | Cu | B. | Cu(OH)2 | C. | CuO | D. | NaOH |
①Al2O3 ②Ca(OH)2 ③Na2CO3 ④Al ⑤NaHCO3.
| A. | ①② | B. | ②③ | C. | ①④⑤ | D. | ①④ |
| A. | Mg2+、K+、SO42-、NO3- | B. | Ba2+、Mg2+、SO42+、Cl- | ||
| C. | OH-、K+、Na+、H+ | D. | H+、K+、Cl-、CO32- |