题目内容
下列事实中,能说明氯的非金属性比硫强的是( )
①HClO的氧化性比H2SO4的氧化性强
②常温下氯气是气态而硫是固态
③盐酸酸性比氢硫酸强
④HCl比H2S稳定
⑤H2S能被Cl2氧化成硫
⑥SCl2分子中氯显-1价
⑦氯气与氢气化合比硫与氢气化合要容易进行
⑧Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
①HClO的氧化性比H2SO4的氧化性强
②常温下氯气是气态而硫是固态
③盐酸酸性比氢硫酸强
④HCl比H2S稳定
⑤H2S能被Cl2氧化成硫
⑥SCl2分子中氯显-1价
⑦氯气与氢气化合比硫与氢气化合要容易进行
⑧Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
| A、①②③④⑤⑥⑦⑧ |
| B、①④⑤⑥⑦ |
| C、④⑤⑥⑦⑧ |
| D、③④⑤⑦⑧ |
考点:非金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:根据非金属元素对应离子的还原性、气态氢化物的稳定性、最高价氧化物水化物的酸性、单质之间的置换反应等来比较非金属性,以此来解答.
解答:
解:①比较非金属性强弱,应用最高价氧化物对应的水化物的酸性,HClO的氧化性比H2SO4的氧化性强,不能用于比较,故错误;
②常温下氯气是气态而硫是固态,属于物理性质,不能用于比较化学性质,故错误;
③比较非金属性强弱,应用最高价氧化物对应的水化物的酸性,不能用氢化物的酸性比较,故错误;
④HCl比H2S稳定,说明非金属性Cl>S,故正确;
⑤元素的非金属性越强,对应的单质的氧化性越强,H2S能被Cl2氧化成硫,可说明非金属性Cl>S,故正确;
⑥SCl2分子中氯显-1价,可说明Cl元素易得到电子,非金属性较强,故正确;
⑦氯气与氢气化合比硫与氢气化合要容易进行,可说明Cl非金属性较强,故正确;
⑧Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS,说明氯气易得到电子,元素的非金属性较强,故正确.
故选C.
②常温下氯气是气态而硫是固态,属于物理性质,不能用于比较化学性质,故错误;
③比较非金属性强弱,应用最高价氧化物对应的水化物的酸性,不能用氢化物的酸性比较,故错误;
④HCl比H2S稳定,说明非金属性Cl>S,故正确;
⑤元素的非金属性越强,对应的单质的氧化性越强,H2S能被Cl2氧化成硫,可说明非金属性Cl>S,故正确;
⑥SCl2分子中氯显-1价,可说明Cl元素易得到电子,非金属性较强,故正确;
⑦氯气与氢气化合比硫与氢气化合要容易进行,可说明Cl非金属性较强,故正确;
⑧Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS,说明氯气易得到电子,元素的非金属性较强,故正确.
故选C.
点评:本题考查非金属性的比较,明确常见的比较方法是解答本题的关键,注重知识的归纳总结,题目难度不大.

练习册系列答案
相关题目
将氢气、甲烷、乙醇等物质在氧气中燃烧时的化学能直接转化为电能的装置叫燃料电池.燃料电池的基本组成为电极、电解质、燃料和氧化剂.此种电池能量利用率可高达80(一般柴油发电机只有40%左右),产物污染也少.下列有关燃料电池说法错误的是( )
| A、上述燃料电池的负极反应材料是氢气、甲烷、乙醇等物质 |
| B、氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇航员使用 |
| C、乙醇燃料电池的电解质常用KOH,该电池的负极反应为C2H5OH-12e-═2CO2↑+3H2O |
| D、KOH作电解质的甲烷燃料电池的正极反应为O2+2H2O+4e-═4OH- |
下列是三种有机物的结构简式
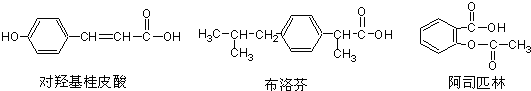
下列说法正确的是( )

下列说法正确的是( )
| A、三种有机物都能发生水解反应 |
| B、三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 |
| C、三种物质中,其中有两种互为同分异构体 |
| D、三种物质在一定条件下,均可以与H2发生加成反应 |
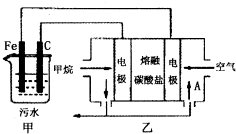 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )| A、为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 |
| B、甲装置中Fe电极的反应为Fe-3e-=Fe3+ |
| C、为了增加污水的导电能力,应向污水中如入适量的H2SO4溶液 |
| D、当乙装置中有1.6g CH4参加反应,则C电极理论上生成气体在标准状况下为4.48L |
在一固定容积的密闭容器中,可逆反应N2+3H2?2NH3达到平衡的标志是( )
| A、v(N2)正=v(NH3)逆 |
| B、单位时间内3molH-H键断裂,同时6mol N-H键断裂 |
| C、n(N2):n(H2):(NH3)=1:3:2 |
| D、反应混合物各组分的物质的量浓度还在改变 |
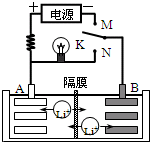 如图是一种可充电的锂离子电池充、放电的工作示意图.放电时该电池的电极反应式为:
如图是一种可充电的锂离子电池充、放电的工作示意图.放电时该电池的电极反应式为:负极:LixC6-xe-═C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)
正极:Li1-xMnO2+xLi++x e-═LiMnO2(LiMnO2表示含锂原子的MnO2)
下列有关说法正确的是( )
A、该电池的反应式为Li1-xMnO2+LixC6
| |||
| B、K与M相接时,A是阳极,发生氧化反应 | |||
| C、K与N相接时,Li+由A极区迁移到B极区 | |||
| D、在整个充电或放电过程中都只存在一种形式的能量转化 |
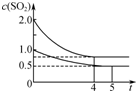 向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g);△H=-197.74kJ?mol-1.
向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g);△H=-197.74kJ?mol-1.一段时间后达到平衡,测得两容器中c(SO2)(mol?L-1)随时间t(min)的变化关系如图所示.下列说法正确的是( )
| A、热量:Q(甲)<2Q(乙) |
| B、压强:p(甲)<2p(乙) |
| C、乙中前5 min内的反应速率v(O2)=0.10 mol?L-1?min-1 |
| D、保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2 mol O2、0.4 mol SO3,则此时v(正)<v(逆) |
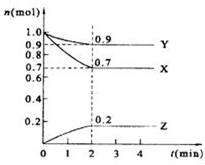 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.