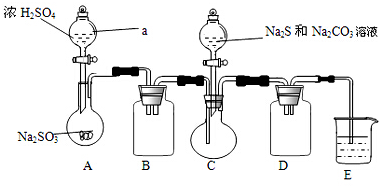
题目内容
短周期元素X、Y、Z、W的原子序数依次增大,X的原子在元素周期表中原子半径最小,Y的次外层电子数是最外层的
,ZX2是一种储氢材料,W与Y属于同一主族.下列叙述正确的是( )
| 1 |
| 3 |
| A、原子半径:rW>rZ>rY |
| B、Y形成的离子与W形成的离子的电子数不可能相同 |
| C、化合物X2Y、ZY、WY3中化学键的类型相同 |
| D、由X、Y、Z、W组成的化合物的水溶液可能显酸性 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:短周期元素X、Y、Z、W的原子序数依次增大,X的原子在元素周期表中原子半径最小,则X为H元素;Y的次外层电子数是最外层的
,Y原子只能有2个电子层,最外层电子数为6,则Y为O元素;W与Y属于同一主族,则W为S元素;ZX2中,H显-1价,Z显+2价,则Z为Mg,以此解答该题.
| 1 |
| 3 |
解答:
解:短周期元素X、Y、Z、W的原子序数依次增大,X的原子在元素周期表中原子半径最小,则X为H元素;Y的次外层电子数是最外层的
,Y原子只能有2个电子层,最外层电子数为6,则Y为O元素;W与Y属于同一主族,则W为S元素;ZX2中,H显-1价,Z显+2价,则Z为Mg,
A.原子半径最小的原子X为H,同周期随原子序数增大原子半径减小,故原子半径Mg>S>O,故A错误;
B.O22-?与S2-电子数都是18,故B错误;
C.H2O和SO3中均为共价键,MgO中为离子键,故C错误;
D.MgSO4?7H2O中Mg2+水解显酸性,故D正确.
故选D.
| 1 |
| 3 |
A.原子半径最小的原子X为H,同周期随原子序数增大原子半径减小,故原子半径Mg>S>O,故A错误;
B.O22-?与S2-电子数都是18,故B错误;
C.H2O和SO3中均为共价键,MgO中为离子键,故C错误;
D.MgSO4?7H2O中Mg2+水解显酸性,故D正确.
故选D.
点评:本题考查结构位置性质关系应用、元素周期律、化学键、盐类水解等,为高频考点,侧重于学生的分析能力的考查,难度中等,推断元素是解题关键.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
短周期元素A、B、C、D的原子序数依次增大.A原子的最外层电子数是内层电子数的2倍,元素B在同周期的主族元素中原子半径最大,元素C的合金是日常生活中常用的金属材料,元素D位于第ⅥA族.下列说法正确的是( )
| A、原子半径:D>B>C>A |
| B、元素A、B的氧化物所含化学键的类型完全相同 |
| C、元素B和C的最高价氧化物对应水化物的碱性:B<C |
| D、元素B、C、D的最高价氧化物对应的水化物能相互反应 |
下列有关实验原理、方法和结论都正确的是( )
| A、向溴水中滴入植物油,振荡后,油层显无色,说明溴不溶于油脂 |
| B、向蛋白质溶液中加入硫酸铜溶液,将得到的沉淀分离出来,再加水可重新溶解 |
| C、pH都为3的酸HA和HB分别与足量Mg反应,HA放出的H2多,说明酸性HA<HB |
| D、淀粉在稀硫酸的作用下水解后,加入氢氧化钠使溶液呈碱性,再加入新制Cu(OH)2后加热,若有砖红色沉淀生成,则淀粉已经开始水解 |
下列各离子浓度的比较,正确的是( )
| A、0.1mol?L-1 CH3COONa溶液中:c(OH-)>c(CH3COOH)+c(H+) |
| B、0.1mol?L-1的NH4Cl溶液与0.05mol?L-1的NaOH溶液等体积混合后溶液显碱性:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
| C、酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,则:c(Na+)>c(HB-)>c(OH-)>c(B2-)>c(H+) |
| D、1.0L 0.3mol?L-1 NaOH溶液缓慢通入CO2气体至溶液增重8.8g,所得溶液中:c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+) |
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色.Q元素的原子最外层电子数是其内层电子数的2倍.W、Z最外层电子数相同,Z的核电荷数是W的2倍.元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是( )
| A、原子半径的大小顺序:rX>rY>rW>rQ |
| B、X、Y的最高价氧化物的水化物之间不能发生反应 |
| C、元素Q和Z能形成QZ2型的共价化合物 |
| D、Z元素的氢化物稳定性大于W元素的氢化物稳定性 |
下列叙述正确的是( )


| A、雌二醇和睾丸素两种物质的分子组成相差一个CH2,但不属于同系物 |
B、按系统命名法,有机物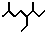 可命名为2,6-二甲基-4-乙基辛烷 可命名为2,6-二甲基-4-乙基辛烷 |
| C、氯气与甲烷在光照射的取代反应历程为:光照下,甲烷分子失去一个氢原子和甲基,甲基再与Cl2碰撞生成CH3Cl和氯自由基(Cl?) |
D、瘦肉精学名克伦特罗,结构如图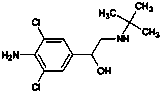 ,可以发生取代、加成、水解、酯化、消去反应 ,可以发生取代、加成、水解、酯化、消去反应 |
常温下,将20mL 0.1mol/L的HCl溶液逐滴加入到20mL 0.1mol/L Na2C2O4溶液中.已知NaHC2O4溶液显酸性,关于反应混合溶液的下列判断不正确的是( )
| A、加水稀释时,溶液中c(OH-)增大,其余离子浓度均减小 | ||
B、
| ||
| C、c(Na+)>c(Cl-)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | ||
| D、c(Cl-)=c(HC2O4-)+2c(C2O42-)+c(HC2O4) |
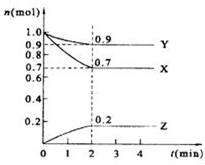 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.