题目内容
实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,回答下列问题:
(1)已知某温度下某反应的化学平衡常数表达式为:K=
,它所对应的化学反应为: .
(2)已知在一定温度下,
①C(s)+CO2(g)?2CO(g)△H1=a kJ/mol;平衡常数K1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2=b kJ/mol;平衡常数K2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3;平衡常数K3.
则K1、K2、K3之间的关系是: ,△H3= (用含a、b的代数式表示).
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为: .
(4)在催化剂存在条件下反应:H2O(g)+CO(g)?CO2(g)+H2(g),CO转化率随蒸气添加量的压强比及温度变化关系如图1所示:

对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP= ,提高
比,则KP (填“变大”、“变小”或“不变”).实际上,在使用铁镁催化剂的工业流程中,一般采用400℃左右、
=3~5.其原因可能是 .
(5)工业上可利用原电池原理除去工业尾气中的CO并利用其电能,反应装置如图2所示,请写出负极的电极反应式: .
(1)已知某温度下某反应的化学平衡常数表达式为:K=
| c(H2O) |
| c(CO)?c(H2) |
(2)已知在一定温度下,
①C(s)+CO2(g)?2CO(g)△H1=a kJ/mol;平衡常数K1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2=b kJ/mol;平衡常数K2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3;平衡常数K3.
则K1、K2、K3之间的关系是:
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(4)在催化剂存在条件下反应:H2O(g)+CO(g)?CO2(g)+H2(g),CO转化率随蒸气添加量的压强比及温度变化关系如图1所示:

对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=
| P[H2O(g)] |
| P(CO) |
| P[H2O(g)] |
| P(CO) |
(5)工业上可利用原电池原理除去工业尾气中的CO并利用其电能,反应装置如图2所示,请写出负极的电极反应式:
考点:化学平衡常数的含义,化学电源新型电池,化学平衡的计算
专题:化学平衡专题,电化学专题
分析:(1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,平衡常数中,分子为生成物,分母为反应物和质量恒定律分析解题;
(2)根据平衡常数的表达式推断;应用盖斯定律来求△H3;
(3)平衡常数随温度的变化来判断正反应方向是吸热还是放热,应用三行式结合平衡常数来求转化率;
(4)将化学平衡常数中的浓度c换成压强P就可以得到KP;根据平衡常数只与温度有关,与浓度无关;投料比太低,CO的转化率不太高,投料比太高,经济上不合算以及考虑催化剂的活性来解答;
(5)负极发生氧化反应.
(2)根据平衡常数的表达式推断;应用盖斯定律来求△H3;
(3)平衡常数随温度的变化来判断正反应方向是吸热还是放热,应用三行式结合平衡常数来求转化率;
(4)将化学平衡常数中的浓度c换成压强P就可以得到KP;根据平衡常数只与温度有关,与浓度无关;投料比太低,CO的转化率不太高,投料比太高,经济上不合算以及考虑催化剂的活性来解答;
(5)负极发生氧化反应.
解答:
解:(1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,平衡常数中,分子为生成物,分母为反应物,所以该反应的方程式为CO(g)+H2(g)?C(s)+H2O(g),故答案为:CO(g)+H2(g)?C(s)+H2O(g);
(2)根据化学方程式可知:K1=
,K2=
,K3=
,所以:K3=K1×K2;由①+②可得方程式C(s)+H2O(g)?CO(g)+H2(g),所以△H3=(a+b)kJ/mol,故答案为:K3=K1×K2;(a+b)kJ/mol;
(3)由图可知温度越高K值越小,说明正反应为放热反应,
对于反应 CO(g)+H2O(g)?H2(g)+CO2(g),
开始(mol/L):0.02 0.02 0 0
变化(mol/L):c c c c
平衡(mol/L):0.02-c 0.02-c c c
所以
=9,解得c=0.015
所以CO的转化率为
×100%=75%,
故答案为:放热;75%;
(4)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),反应的平衡常数=
;平衡常数只与温度有关,与浓度无关,所以提高
比,则KP不变;由图象可知,投料比太低,CO的转化率不太高,而投料比3~5:1时转化率已经很高达到96%~98%,再增加投料比,需要大大的增加蒸汽添加量,这样在在经济上不合算,催化剂的活性温度在400℃左右,所以一般采用400℃左右,H2O(气):CO=3~5;
故答案为:
;不变;投料比太低,CO的转化率不太高,而投料比3~5时转化率已经很高达到96%~98%,再增加投料比,需要大大的增加蒸汽添加量,这样在在经济上不合算,催化剂的活性温度在400℃左右;
(5)负极发生氧化反应,CO-2e-+CO32-=2CO2,故答案为:CO-2e-+CO32-=2CO2.
(2)根据化学方程式可知:K1=
| c2(CO) |
| c(CO2) |
| c(H2)×c(CO2) |
| c(CO)×c(H2O) |
| c(CO)×c(H2) |
| c(H2O) |
(3)由图可知温度越高K值越小,说明正反应为放热反应,
对于反应 CO(g)+H2O(g)?H2(g)+CO2(g),
开始(mol/L):0.02 0.02 0 0
变化(mol/L):c c c c
平衡(mol/L):0.02-c 0.02-c c c
所以
| c×c |
| (0.02-c)×(0.02-c) |
所以CO的转化率为
| 0.015mol/L |
| 0.02mol/L |
故答案为:放热;75%;
(4)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),反应的平衡常数=
| P(CO2)P(H2) |
| P(CO)P(H2O) |
| H2O(g) |
| CO |
故答案为:
| P(CO2)P(H2) |
| P(CO)P(H2O) |
(5)负极发生氧化反应,CO-2e-+CO32-=2CO2,故答案为:CO-2e-+CO32-=2CO2.
点评:本题考查了反应的平衡常数和盖斯定律、图象分析判断的方法、平衡三段法的计算、原电池原理的分析判断和电极反应的分析判断,掌握基础是解题的关键,题目难度中等.

练习册系列答案
相关题目
在一固定容积的密闭容器中,可逆反应N2+3H2?2NH3达到平衡的标志是( )
| A、v(N2)正=v(NH3)逆 |
| B、单位时间内3molH-H键断裂,同时6mol N-H键断裂 |
| C、n(N2):n(H2):(NH3)=1:3:2 |
| D、反应混合物各组分的物质的量浓度还在改变 |
下列有关物质性质的应用正确的是( )
| A、石英坩埚耐高温,可用来加热熔化NaOH固体 |
| B、浓硫酸有脱水性,可用作干燥剂 |
| C、二氧化硫有漂白性,可大量用于加工食品使食品漂白 |
| D、医用酒精能使蛋白质变性,可用来消毒杀菌 |
21世纪化学的最新定义为“化学是一门创造新物质的科学”.下列有关说法不正确的是( )
| A、利用人工光合成反应,探究将二氧化碳转化为碳氢化合物作燃料,属于低碳技术 |
| B、开发安全、高效、低毒及低残留的新型农药 |
| C、加大稀土资源的开采和出口,制造更多高新产品,保证经济快速发展 |
| D、制备物质时探究化学反应中高选择性、转化率和原子利用率,属于“绿色”的生产工艺 |
NA代表阿伏加德罗常数,以下说法正确的是( )
| A、常温常压下1mol N02气体与水反应生成NA个N03-离子 |
| B、在1L 0.2mol/L的硫酸铁溶液中含有的Fe3+数为0.4NA |
| C、标准状况下,3.36L丁烷中含有的非极性键数为0.6NA |
| D、1mol KHSO4熔融态中含有离子总数为2NA |
下列各离子浓度的比较,正确的是( )
| A、0.1mol?L-1 CH3COONa溶液中:c(OH-)>c(CH3COOH)+c(H+) |
| B、0.1mol?L-1的NH4Cl溶液与0.05mol?L-1的NaOH溶液等体积混合后溶液显碱性:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
| C、酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,则:c(Na+)>c(HB-)>c(OH-)>c(B2-)>c(H+) |
| D、1.0L 0.3mol?L-1 NaOH溶液缓慢通入CO2气体至溶液增重8.8g,所得溶液中:c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+) |
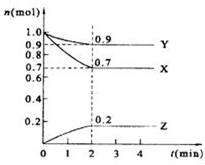 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.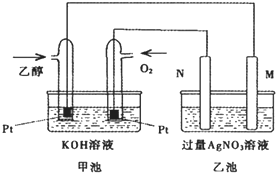 如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: