题目内容
11.随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点.(1)为了提高煤的燃烧效率,常采取的措施是将煤转化为清洁气体燃料--水煤气.
已知:H2(g)+1/2O2(g)═H2O(g)△H1=-241.8kJ•mol-1.
C(s)+1/2O2 (g)═CO(g)△H2=-110.5kJ•mol-1
则焦炭与水蒸气反应生成水煤气的热化学方程式为C(s)+H2O(g)═CO(g)+H2(g);△H=+13l.30kJ•mol-1.
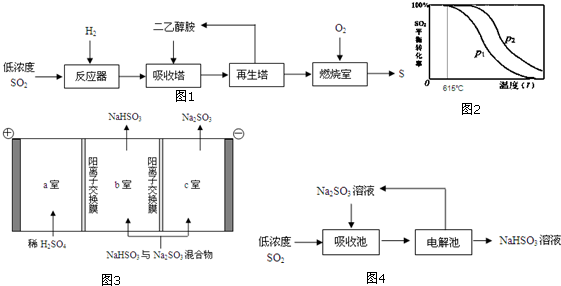
(2)工业上利用水煤气合成甲醇燃料,反应为CO(g)+2H2(g) $\stackrel{催化剂}{?}$CH3OH(g)△H<0.在一定条件下,将l mol CO和2mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图1所示:
①平衡时,M点CH3OH的体积分数为10%.则CO的转化率为25%.
②X轴上a点的数值比b点小(填“大”或“小”).Y轴表示温度(填“温度”或“压强”),判断的理由是随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,平衡逆向移动,故Y表示温度.
(3)在一定温度下,将2mol CO和4mol也充入某恒容密闭容器中发生反应:CO(g)+2H2(g) $\stackrel{催化剂}{?}$CH3OH(g),达到平衡时测得CO的转化率为50%,已知反应初始时容器的容积为2L,则该温度下,反应的平衡常数K=1.
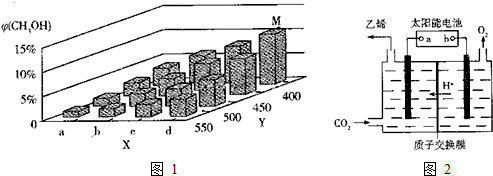
(4)在合成水煤气时会产生一定量的CO2,在强酸性电解质溶液中,用惰性电极电解可使CO2转化成乙烯,如图2所示.电解时阴极的电极反应式为2CO2+12H++12e-=C2H4+4H2O.当阳极产生l mol气体时,则阳极溶液的质量减轻36 g.
分析 (1)已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.81kJ•mol-1,
②C(s)+$\frac{1}{2}$O2(g)═CO(g);△H=-110.51kJ•mol-1,
利用盖斯定律,将②-①可得:C(s)+H2O(g)=CO(g)+H2(g,据此计算焓变书写热化学方程式;
(2)①根据三行式计算得到;
②根据图示信息:X轴上a点的数值比b点小,随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,结合平衡移动原理回答;
(3)CO的转化率为50%,则反应消耗的CO的物质的量为:2mol×50%=1mol,根据反应CO(g)+2H2(g)$\frac{\underline{\;催化剂\;}}{\;}$CH30H(g)分别计算出反应消耗氢气、生成甲醇的物质的量,然后根据c=$\frac{n}{V}$分别计算出平衡时一氧化碳、氢气、甲醇的浓度,最后根据K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$计算出该反应在该温度下的平衡常数;
(4)电解强酸性的二氧化碳水溶液得到乙烯,乙烯在阴极生成.
解答 解:(1)已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.81kJ•mol-1,
②C(s)+$\frac{1}{2}$O2(g)═CO(g);△H=-110.51kJ•mol-1,
利用盖斯定律,将②-①可得:C(s)+H2O(g)=CO(g)+H2(g),△H=(-110.5kJ/mol)-(-241.8kJ/mol)=+13l.3 kJ/mol,
所以焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g);△H=+13l.30kJ•mol-1,
故答案为:C(s)+H2O(g)═CO(g)+H2(g);△H=+13l.30kJ•mol-1;
(2)①设CO的转化量是x,则
CO(g)+2H2(g)?CH3OH(g);
初始量:1mol 2mol 0
变化量:x 2x x
平衡量:1-x 2-2x x
平衡时,CH3OH的体积分数为10%,则$\frac{x}{1-x+2-2x+x}$×100%=10%,x=0.25,所以CO的转化率为$\frac{0.25mol}{1mol}$×100%=25%,故答案为:25%;
②根据图示信息:X轴上a点的数值比b点小,随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,平衡逆向移动,故Y表示温度,故答案为:小;温度;随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,平衡逆向移动,故Y表示温度;
(3)CO的转化率为50%,则反应消耗的CO的物质的量为:2mol×50%=1mol,根据反应CO(g)+2H2(g)=CH30H(g)可知,反应消耗氢气的物质的量为1mol×2=2mol,反应生成甲醇的物质的量为1mol,
则达到平衡时各组分的浓度为:c(CO)=0.5mol/L,c(H2)=1mol/L,c(CH30H)=0.5mol/L,
所以该温度下该反应的平衡常数为:K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$=$\frac{0.5}{0.5×{1}^{2}}$=1,
故答案为:1;
(4)电解时,二氧化碳在阴极上生成乙烯,电极反应式为2CO2+12H++12e-=C2H4+4H2O,在阳极上发生反应:4OH--4e-=O2↑+2H2O,阳极产生lmol氧气时,消耗2mol水,质量减轻36g,故答案为:2CO2+12H++12e-=C2H4+4H2O;36.
点评 本题考查了化学平衡常数的计算、平衡移动原理的应用,题目难度中等,明确化学平衡常数的概念及表达式为解答关键,本题也可以利用三段式计算,试题培养了学生的分析能力及化学计算能力.

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案| A. | 原子序数:X>Y | |
| B. | 非金属性:X>Y | |
| C. | 最高价氧化物对应的水化物酸性:X>Y | |
| D. | 原子半径:X>Y |
| A. | 离子半径:r(Z2+)>r(Y2-) | |
| B. | Y的气态简单氢化物的热稳定性比氮元素的气态简单氢化物强 | |
| C. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| D. | X、Y、Z、W元素的最高正价均等于其所在族的族序数 |
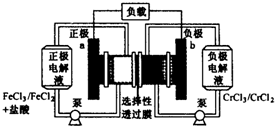 铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如下图所示,工作原理为:Fe3++Cr2+$?_{充电}^{放电}$Fe2++Cr3+.下列说法正确的是( )
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如下图所示,工作原理为:Fe3++Cr2+$?_{充电}^{放电}$Fe2++Cr3+.下列说法正确的是( )| A. | 电池充电时,b极的电极反应式为Cr3++e-=Cr2+ | |
| B. | 电池充电时,Cl-从a极穿过选择性透过膜移向b极 | |
| C. | 电池放电时,a极的电极反应式为Fe3++3e-=Fe | |
| D. | 电池放电时,电路中每通过0.1mol电子,Fe3+浓度降低0.1 mol•L-1 |
| A. | 光伏发电是将化学能转化为电能 | |
| B. | 钢铁吸氧腐蚀正极的电极反应式是O2+4e-+2H2O=4OH- | |
| C. | 通过电解NaCl水溶液的方法生产金属钠 | |
| D. | 铅蓄电池的负极材料是Pb,正极材料是PbSO4 |
| A. | 二氧化氯具有强氧化性,可用于杀菌消毒 | |
| B. | 氢氧化铝具有弱碱性,可用于治疗胃酸过多 | |
| C. | 二氧化硅的熔沸点很高,可用于制作石英坩埚 | |
| D. | 钠钾合金的密度小,可用于快中子反应堆的热交换剂 |
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
(2)Na2S2O3和H2SO4反应的化学方程式为Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.
(3)若实验①中加入反应物各5mL后加入10mL水,出现浑浊的时间为t1,实验②中加入反应物各5mL后加入30mL水,出现浑浊的时间为t2,则t1=t2(选填“>”、“<”或“=”)
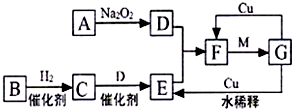 下图是由短周期元素组成的一些单质及其化合物之间的转化关系图(某些反应的条件和生成物已略去),其中A、B、D在常温下均为无色无刺激性气味的气体,M是最常见的无色液体.
下图是由短周期元素组成的一些单质及其化合物之间的转化关系图(某些反应的条件和生成物已略去),其中A、B、D在常温下均为无色无刺激性气味的气体,M是最常见的无色液体. .
.