题目内容
12.用惰性电极电解含下列离子的水溶液,若转移电子数目相同的情况下,阴极析出质量最大的物质( )| A. | Ag+ | B. | Cu2+ | C. | Na+ | D. | Hg2+ |
分析 电解下列离子的水溶液,在金属活动性顺序表中,位于氢之前的金属离子溶液中,阴极上氢离子放电,位于氢之后的金属离子溶液中,金属离子得电子,析出金属单质,根据转移电子相等计算析出物质的物质的量,再根据m=nM计算析出物质质量.
解答 解:假设都是转移1mol电子,
A.电解可溶性银盐溶液时,阴极上析出Ag,根据Ag++e-=Ag知,析出n(Ag)=1mol,m(Ag)=1mol×108g/mol=108g;
B.电解可溶性铜盐溶液时,阴极上析出Cu,根据Cu2++2e-=Cu知,析出n(Cu)=0.5mol,m(Cu)=0.5mol×64g/mol=32g;
C.电解钠离子的溶液时,阴极上析出氢气,根据2H++2e-=H2↑知,析出n(H2)=0.5mol,m(H2)=0.5mol×2g/mol=1g;
D.电解含有汞离子的溶液时,阴极上析出Hg,根据Hg2++2e-=Hg知,析出n(Hg)=0.5mol,m(Hg)=0.5mol×201g/mol=100.5g;
通过以上分析知,阴极析出物质质量大小顺序是A>D>B>C,故选A.
点评 本题考查以关系式的计算为载体考查电解原理,侧重考查分析计算能力,为高频考点,明确离子放电顺序是解本题关键,熟练掌握金属活动顺序表,题目难度不大.

练习册系列答案
相关题目
2. 想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.
想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.
(1)0.1000mol•L-1NaOH溶液中由水电离出的c(OH)-=1×10-13mol•L-1
(2)滴定时用酸式(填“酸式”或“碱式”)滴定管将待测液移入锥形瓶中.
(3)若滴定时选用的指示剂是酚酞,则终点的想象是滴入最后一滴NaOH标准液,溶液由无色变为粉红色,且半分钟内不褪色
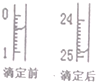
(4)中和滴定有关数据记录如下表,如图表示下表中第1次滴定时50mL滴定管中前后液面的位置
则表中z=24.50mL
(5)根据所给数据,盐酸溶液的物质的量浓度c=0.1020mol•L-1(保留四位有效数字)
(6)下列操作会使测定结果偏高的有ad
a.洗涤碱式滴定管时未用装溶液润洗
b.洗涤时锥形瓶只用蒸馏水洗净后而未润洗
c.读所用标准液体积时,滴定前仰视,滴定后仰视
d.滴定时标准液不小心滴入到锥形瓶外面.
 想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.
想用0.1000mol•L-1NaOH溶液通过中和滴定测定盐酸溶液的物质的量浓度,回答下列问题.(1)0.1000mol•L-1NaOH溶液中由水电离出的c(OH)-=1×10-13mol•L-1
(2)滴定时用酸式(填“酸式”或“碱式”)滴定管将待测液移入锥形瓶中.
(3)若滴定时选用的指示剂是酚酞,则终点的想象是滴入最后一滴NaOH标准液,溶液由无色变为粉红色,且半分钟内不褪色
(4)中和滴定有关数据记录如下表,如图表示下表中第1次滴定时50mL滴定管中前后液面的位置
| 滴定序号 | 待测液体积(mL) | 所消耗NaOH标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 25.00 | x | y | z |
| 2 | 25.00 | 4.00 | 29.60 | 25.60 |
| 3 | 25.00 | 0.60 | 26.00 | 25.40 |
(5)根据所给数据,盐酸溶液的物质的量浓度c=0.1020mol•L-1(保留四位有效数字)
(6)下列操作会使测定结果偏高的有ad
a.洗涤碱式滴定管时未用装溶液润洗
b.洗涤时锥形瓶只用蒸馏水洗净后而未润洗
c.读所用标准液体积时,滴定前仰视,滴定后仰视
d.滴定时标准液不小心滴入到锥形瓶外面.
3.下列叙述正确的是( )
| A. | 在中和热的测定实验中,应将碱液缓慢倒入酸液中,使反应充分进行 | |
| B. | 用NaOH标准溶液滴定醋酸溶液至中性时,醋酸则被完全中和 | |
| C. | 将Na2S2O3溶液和稀硫酸混合,可通过观察产生气泡的快慢来判断化学反应速率 | |
| D. | 将铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色沉淀 |
20.垃圾无害化处理有利于保护生态环境.下列有关生活垃圾的处理合理的是( )
| A. | 废旧塑料露天焚烧 | B. | 用厨房垃圾生产沼气 | ||
| C. | 废旧电池就地填埋 |
7.下列说法不正确的是( )
| A. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 | |
| B. | 乙酸乙酯的制备实验中,饱和Na2CO3溶液不仅可以降低乙酸乙酯的溶解度,还能吸收挥发出来的乙醇及乙酸 | |
| C. | “中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 | |
| D. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
4.查阅资料:无水醋酸钠是无色无味的结晶体,在空气中可被风化,可燃.用无水醋酸钠与碱石灰加热可以制得X气体.并作相应的实验:
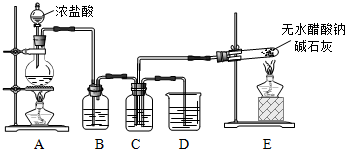
(1)装置E中反应方程式是CH3COONa+NaOH$→_{△}^{CaO}$Na2CO3+X↑,X的化学式是CH4.
(2)在C中收集气体X和Cl2为1:1体积混合,然后在光照下反应:
①B装置的作用是除去Cl2中含有的HCl;
②C装置所盛放试剂是饱和食盐水;光照后所得产物有CH3Cl、CH2Cl2、CHCl3、CCl4、HCl;
(3)设计一个实验方案,验证产物中生成了一种无机物:光照后,取C和D中液体各少许,分别加入两支试管中,再分别滴加2滴石蕊溶液,C中溶液红色更深;或用pH试纸测定C和D中溶液的pH等
(4)某学生为了测定X的组成进行实验探究,选用了下列仪器:
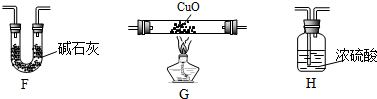
①该同学依次连接的合理顺序是E、G、H、F;
②该同学测定的相关数据是:
数据是否完全,说明原因数据是不完全,因为只能确定有机物中的碳氢元素含量,不能确定是否含有氧元素,应称取C装置实验前后的质量;
该测定含氢量是否有偏差?若有偏差,请说明原因F中吸收的是CO2,CO2质量33.6g-22.5g=11.1g,n(C)=$\frac{11.1g}{44g/mol}$=0.252mol;H中吸收的是水蒸气,H2O质量51.4g-42.4g=9.0g,n(H)=$\frac{9.0g}{18g/mol}$×2=1.0mol;
故n(C):n(H)>1:4.原因是F装置后面与空气接触,空气中的水蒸气和CO2进入了B装置,造成含碳量偏大.

(1)装置E中反应方程式是CH3COONa+NaOH$→_{△}^{CaO}$Na2CO3+X↑,X的化学式是CH4.
(2)在C中收集气体X和Cl2为1:1体积混合,然后在光照下反应:
①B装置的作用是除去Cl2中含有的HCl;
②C装置所盛放试剂是饱和食盐水;光照后所得产物有CH3Cl、CH2Cl2、CHCl3、CCl4、HCl;
(3)设计一个实验方案,验证产物中生成了一种无机物:光照后,取C和D中液体各少许,分别加入两支试管中,再分别滴加2滴石蕊溶液,C中溶液红色更深;或用pH试纸测定C和D中溶液的pH等
(4)某学生为了测定X的组成进行实验探究,选用了下列仪器:

①该同学依次连接的合理顺序是E、G、H、F;
②该同学测定的相关数据是:
| 装置 | 实验前的质量/g | 实验后的质量/g |
| F | 22.5 | 33.6 |
| H | 42.4 | 51.4 |
该测定含氢量是否有偏差?若有偏差,请说明原因F中吸收的是CO2,CO2质量33.6g-22.5g=11.1g,n(C)=$\frac{11.1g}{44g/mol}$=0.252mol;H中吸收的是水蒸气,H2O质量51.4g-42.4g=9.0g,n(H)=$\frac{9.0g}{18g/mol}$×2=1.0mol;
故n(C):n(H)>1:4.原因是F装置后面与空气接触,空气中的水蒸气和CO2进入了B装置,造成含碳量偏大.
1.某元素原子的结构示意图为 ,关于该原子说法正确的是( )
,关于该原子说法正确的是( )
 ,关于该原子说法正确的是( )
,关于该原子说法正确的是( )| A. | 核电荷数为32 | B. | 核外电子数为6 | ||
| C. | 有3个电子层 | D. | 比其阴离子多2个电子 |
2.分子式为C8H10的芳香烃,苯环上的一氯代物只有一种,该芳香烃的名称是( )
| A. | 乙苯 | B. | 对二甲苯 | C. | 间二甲苯 | D. | 邻二甲苯 |
 化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学.
化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学.