题目内容
11.下列各组物质中,化学键类型不同的是( )| A. | NaOH和NH4NO3 | B. | H2O和NH3 | C. | CaF2和CsCl | D. | CCl4和Na2O |
分析 活泼金属和活泼非金属元素易形成离子键,非金属元素之间易形成共价键,据此分析.
解答 解:A.NaOH中含有共价键和离子键,NH4NO3中含有共价键和离子键,故A不选;
B.H2O和NH3中只存在共价键,故B不选,
C.CaF2和CsCl只存在离子键,故C不选.
D.CCl4中只存在共价键,Na2O只存在离子键,故D选.
故选D.
点评 本题考查了化学键的判断,易错选项是B,注意氯化铝是共价化合物不是离子化合物,注意铵盐中含有离子键和共价键,题目难度不大.

练习册系列答案
相关题目
1.某元素原子的结构示意图为 ,关于该原子说法正确的是( )
,关于该原子说法正确的是( )
 ,关于该原子说法正确的是( )
,关于该原子说法正确的是( )| A. | 核电荷数为32 | B. | 核外电子数为6 | ||
| C. | 有3个电子层 | D. | 比其阴离子多2个电子 |
2.分子式为C8H10的芳香烃,苯环上的一氯代物只有一种,该芳香烃的名称是( )
| A. | 乙苯 | B. | 对二甲苯 | C. | 间二甲苯 | D. | 邻二甲苯 |
19.4-甲基-2-乙基-1-戊烯,经加氢后产物的名称是( )
| A. | 2,4-二甲基己烷 | B. | 2,5-二甲基己烷 | ||
| C. | 4-甲基-2-乙基戊烷 | D. | 2-乙基-4-甲基戊烷 |
6.甲、乙是周期表中同一主族两种元素,若甲的原子序数为x,则乙的原子序数不可能( )
| A. | x+10 | B. | x+12 | C. | x+16 | D. | x+50 |
16.化学反应总是伴随着丰富多彩的颜色的变化,下列说法错误的是( )
| A. | 将Na2O2固体投入滴加了少许酚酞的蒸馏水中,溶液先变红后褪色 | |
| B. | 用玻璃棒蘸取浓硝酸滴加到pH试纸上,试纸先变红后变成白色 | |
| C. | 向胆矾晶体(CuSO4•5H2O)滴加浓硫酸,晶体由蓝色变为黑色 | |
| D. | 将SO2通入品红溶液中,溶液颜色褪去,加热后又变成红色 |
3. Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍.下列说法正确的是( )
Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍.下列说法正确的是( )
 Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍.下列说法正确的是( )
Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍.下列说法正确的是( )| A. | 原子半径大小顺序为r(Q)>r(R)>r(T)>r(M)>r(W) | |
| B. | Q、W的单核离子的核外电子数相等 | |
| C. | 五种元素均能形成氢化物 | |
| D. | W的氢化物水溶液酸性最强,说明W的非金属性在五种元素中最强 |
20.现有几种元素的性质或原子结构如表:
(1)元素X的一种同位素可用来测定一些文物的年代,这种同位素的符号是614C;
(2)画出T的离子结构示意图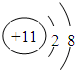 ;
;
(3)写出实验室利用浓盐酸和二氧化锰制取单质Z的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)由T和Y两种元素组成的一种阴阳离子个数比为1:2的过氧化物,其电子式为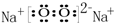 .写出该物质的一种用途作供氧剂
.写出该物质的一种用途作供氧剂
(5)T、Z的最高价氧化物对应的水化物相互反应的化学方程式为NaOH+HClO4=NaClO4+H2O.
| 元素编号 | 元素性质或原子结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,是最常见的助燃剂 |
| Z | 形成双原子单质分子,黄绿色气体 |
(2)画出T的离子结构示意图
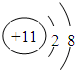 ;
;(3)写出实验室利用浓盐酸和二氧化锰制取单质Z的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)由T和Y两种元素组成的一种阴阳离子个数比为1:2的过氧化物,其电子式为
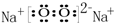 .写出该物质的一种用途作供氧剂
.写出该物质的一种用途作供氧剂(5)T、Z的最高价氧化物对应的水化物相互反应的化学方程式为NaOH+HClO4=NaClO4+H2O.
1.14C是碳的一种同位素,NA为阿伏加德罗常数,下列说法不正确的是( )
| A. | 1mol14CH4分子中所含中子数为8NA | |
| B. | 7g14C原子形成的石墨中所含质子数为3NA | |
| C. | 17g甲基(-14CH3)所含电子数为8NA | |
| D. | 标准状况下22.4L14CO2的分子数为NA |