题目内容
12.现有①MgC12 ②金刚石 ③NaOH ④干冰 ⑤碘晶体 五种物质,按下列要求回答:(1)熔化时不需要破坏化学键的是干冰、碘晶体,熔化时需要破坏共价键的是金刚石,熔点最高的是金刚石,熔点最低的是干冰;
(2)属于离子化合物的是氯化镁、氢氧化钠,只有离了键的物质是氯化镁,晶体以分子间作用力结合的是干冰、碘晶体.
分析 (1)氯化镁属于离子晶体,金刚石属于原子晶体,氢氧化钠属于离子晶体,干冰属于分子晶体,碘晶体属于分子晶体,分子晶体熔化时不需要破坏化学键,原子晶体、离子晶体熔化时需要破坏化学键;
一般物质熔点:原子晶体>离子晶体>分子晶体,分子晶体中相对分子质量越大,分子间作用力越强,物质的熔点越高;
(2)氯化镁、氢氧化钠属于离子化合物,氯化镁只含有离子键,分子晶体以分子间作用力结合.
解答 解:(1)氯化镁属于离子晶体,金刚石属于原子晶体,氢氧化钠属于离子晶体,干冰属于分子晶体,碘晶体属于分子晶体,熔化时不需要破坏化学键的是干冰、碘晶体,熔化时需要破坏共价键的是金刚石,氯化镁、氢氧化钠熔化平衡离子键,
一般物质熔点:原子晶体>离子晶体>分子晶体,分子晶体中相对分子质量越大,分子间作用力越强,物质的熔点越高,故熔点最高的是金刚石,熔点最低的是干冰,
故答案为:干冰、碘晶体;金刚石;金刚石;干冰;
(2)氯化镁、氢氧化钠属于离子化合物,氢氧化钠含有离子键、共价键,而氯化镁只含有离子键,干冰、碘晶体以分子间作用力结合,
故答案为:氯化镁;干冰、碘晶体.
点评 本题考查晶体类型、熔沸点高低比较等,注意掌握晶体构成微粒与微粒间作用,理解掌握熔沸点比较规律.

练习册系列答案
相关题目
2.为了达到下表所列的一些有关家庭常用物质的实验要求,请选择合适的化学试剂,将其标号填入对应的空格中.
| 实 验 目 的 | 化学试剂及方法 | 供选择的化学试剂及方法 A.加入硝酸酸化的硝酸银溶液 B.加入食醋,加热 C.灼烧、闻气味 D.加入新制氢氧化铜悬浊液,加热 E.将样品滴在淀粉碘化钾试纸上 |
| 除去热水瓶中的水垢 | ||
| 鉴别蔗糖和葡萄糖 | ||
| 验证味精中是否含有食盐 | ||
| 区别毛织物和棉织物 | ||
| 检验自来水是否含Cl2分子 |
3.“如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动”总结出这条经验规律的科学家是( )
| A. | 门捷列夫 | B. | 盖斯 | C. | 勒夏特列 | D. | 范德华 |
20.下列有关Cl、N、S等非金属元素化合物的说法正确的是( )
| A. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 漂白粉的成分为次氯酸钙 | |
| D. | SO2可用于漂白食品 |
7. 实验室保存下列试剂时应使用如图装置的是( )
实验室保存下列试剂时应使用如图装置的是( )
 实验室保存下列试剂时应使用如图装置的是( )
实验室保存下列试剂时应使用如图装置的是( )| A. | 硝酸银固体 | B. | 烧碱溶液 | C. | 浓硝酸 | D. | 氢氟酸 |
1.下列叙述中,正确的是( )
①过渡金属配合物远比主族金属配合物多
②Cu(H2O)42+中的Cu2+提供空轨道,H2O中的氧原子提供孤对电子形成配位键,1mol该配合物中含有σ键的数目为6NA
③配位化合物中必定存在配位键
④配位键仅存在于配位化合物中.
①过渡金属配合物远比主族金属配合物多
②Cu(H2O)42+中的Cu2+提供空轨道,H2O中的氧原子提供孤对电子形成配位键,1mol该配合物中含有σ键的数目为6NA
③配位化合物中必定存在配位键
④配位键仅存在于配位化合物中.
| A. | ①②④ | B. | ①④ | C. | ①③ | D. | ①②③ |
8.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.如图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
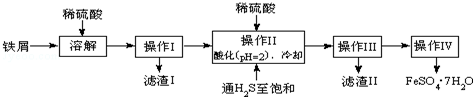
查询资料,得有关物质的数据如下:
(1)写出Fe和Fe2O3在硫酸溶液中发生反应的离子方程式为Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O、2Fe3++Fe=3Fe2+;
(2)操作Ⅱ中,通入硫化氢至饱和的目的是:①除去溶液中的Sn2+离子;②防止Fe2+被氧化;③在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(3)操作IV的顺序依次为蒸发浓缩、冷却结晶、过滤洗涤.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(5)常温下,Ksp[Fe(OH)2]=1.64×10-14,则求得反应:Fe2++2H2O?Fe(OH)2+2H+的平衡常数为:6.1×10-15(保留1位小数).

查询资料,得有关物质的数据如下:
| 25℃时 | pH值 | 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
(2)操作Ⅱ中,通入硫化氢至饱和的目的是:①除去溶液中的Sn2+离子;②防止Fe2+被氧化;③在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(3)操作IV的顺序依次为蒸发浓缩、冷却结晶、过滤洗涤.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(5)常温下,Ksp[Fe(OH)2]=1.64×10-14,则求得反应:Fe2++2H2O?Fe(OH)2+2H+的平衡常数为:6.1×10-15(保留1位小数).